
铝及其化合物在生产生活中的应用广泛。
(1)Al4C3用于冶金及催化剂。与盐酸反应(产物之一是含氢量最高的烃)的化学方程式是: ;14.4g Al4C3与盐酸反应产生的气体是 L(标准状况)。
(2)AlN用于电子仪器。AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入4.032L(标准状况下的)O2,在高温下充分反应后测得气体的密度为1.34g/L(已折算成标准状况,AlN不跟O2反应),则所得气体的摩尔质量为 g/mol,该气体的成分是 (写化学式),该样品中含杂质碳 g。
(3)氯离子插层镁铝水滑石是一种新型的离子交换材料。制备这种水滑石的过程是:MgCl2、AlCl3、NaOH、NaCl溶液,按一定比例混合,在65℃充分反应后,经过滤、洗涤、干燥得到该水滑石。为确定该水滑石的成分,进行如下操作:
①取26.65g样品,在高温下使其充分分解,得到金属氧化物和气体,气体依次通过足量的浓硫酸和浓氢氧化钠溶液,这两种液体分别增重9.9g和3.65g;将金属氧化物在无色火焰上灼烧,火焰仍无色。
②另取26.65g样品,加入足量的稀硝酸,使其完全溶解,再加入NaOH溶液至过量,最终得到11.6g白色沉淀。通过计算确定氯离子插层镁铝水滑石的化学式。
(4)氯离子插层镁铝水滑石在空气中放置,缓慢与CO2反应,部分氯离子会被碳酸根离子代替。26.65g样品在空气中放置一段时间后质量变为25.925g,则碳酸根离子代替部分氯离子的水滑石的化学式是 ,此过程的化学方程式 。
(1)Al4C3+12HCl=3CH4+4AlCl3 6.72(0.1molAl4C3生成0.3mol甲烷)
(2)30.016 CO和CO2 3.84(十字交叉法求得CO 0.28mol CO2 0.04mol)
(3)Mg2Al(OH)6·3H2O
(4)
解析试题分析:(1)Al4C3与盐酸反应产物之一是含氢量最高的烃,可该烃是甲烷,根据水解原理可知化学方程式是:Al4C3+12HCl=3CH4+4AlCl3;14.4g Al4C3物质的量为0.1mol,生成0.3mol甲烷,体积6.72L。
(2)由气体的密度为1.34g/L乘以22.4可得气体的摩尔质量为30.016g/mol,该气体的成分是CO和CO2 ,不可能为氧气和CO2,因为两都的相对分子质量都比30.016大 。运用十字交叉法求得CO 0.28mol CO2 0.04mol,根据碳原子守恒,该样品中含杂质碳0.32mol。求得质量为3.84g。
(3)①取26.65g样品,在高温下使其充分分解,将金属氧化物在无色火焰上灼烧,火焰仍无色。说明没有钠元素。得到金属氧化物为氧化镁和氧化铝,气体是氯化氢和水,气体依次通过足量的浓硫酸和浓氢氧化钠溶液,这两种液体分别增重9.9g(水为0.55mol)和3.65g(氯化氢为0.1mol);
②最终得到11.6g白色沉淀是氢氧化镁,物质的量为0.2mol。
(4)“部分氯离子会被碳酸根离子代替”,由化合价守恒或称电荷守恒,2个氯离子取代一个碳酸根离子。设被替换的Cl2x mol,则CO32- x mol。 发现:消耗Cl0.132 mol,而26.65 g固体本身只有0.1 mol,即固体中只有0.1 mol Cl ,明显不符合题意。也就是说就算Cl全部转化为碳酸根,都无法得到25.925 g固体。设1 mol该化合物吸收a mol CO2,则消耗a mol H2O,替换2a mol Cl 。即该化合物的化学式:
发现:消耗Cl0.132 mol,而26.65 g固体本身只有0.1 mol,即固体中只有0.1 mol Cl ,明显不符合题意。也就是说就算Cl全部转化为碳酸根,都无法得到25.925 g固体。设1 mol该化合物吸收a mol CO2,则消耗a mol H2O,替换2a mol Cl 。即该化合物的化学式:

考点:本题主要考查化学计算,最后一问难度很大。


科目:高中化学 来源: 题型:填空题
某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)该研究小组是否成功制得 +1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
(2)甲与水反应可得H2,其化学方程式是 。反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2· xCa(OH)2· 12H2O。为确定x的值,请设计实验方案 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)该小组不采用生成Fe(OH)3沉淀的方法除去铁元素,是因为生成的Fe(OH)3 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为 ,滴定到终点的颜色变化为 。
(3)通过计算确定黄钠铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1 H2SO4溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
硫化钠是由无水硫酸钠与炭粉在高温下反应制得。反应的化学方程式如下:
① Na2SO4+ 4C→ Na2S+ 4CO↑ ② Na2SO4+ 4CO→ Na2S+ 4CO2↑
(1)要制取Na2S 15.6 g,需原料芒硝(Na2SO4·10H2O)_____________mol。
(2)制得的Na2S固体中含少量Na2SO4、碳粉等杂质。称取该固体0.200 g,加适量水溶解后加入25.0 mL 0.100 mol/L的I2标准液,待反应完全后用0.100 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液16.0 mL(已知:滴定时 Na2S2O3转化为Na2S4O6),则该Na2S的纯度为__________。
(3)① 若在反应过程中,产生CO和CO2混合气体的体积为44.8L(标准状况),生成Na2S的物质的量(n mol)的范围是__________< n < ___________;
② 若在上述过程中生成Na2S的质量为62.4 g,则混合气体中CO和CO2的体积比是多少?
(4)硫化钠晶体(Na2S·9H2O)放置在空气中,会缓慢氧化成Na2SO3·7H2O和Na2SO4·10H2O。现称取在空气中已部分氧化的硫化钠晶体25.76 g溶于水,加入足量用盐酸酸化的BaCl2溶液,过滤得沉淀5.62 g,放出H2S气体1.12 L(标准状况),求原硫化钠晶体的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知Mg能在CO2气体中燃烧(CO2+2Mg  2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
求:(1)在足量CO2气体中,反应结束后所得固体的质量。
(2)在CO2和O2的混合气体中,反应后O2有剩余,则最终固体的质量为_______克。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知反应:SO2+Cl2+2H2O=2HCl+H2SO4,若反应过程中消耗SO2标准状况下2.24L,
则:(1)求转移电子的数目。
(2)反应后溶液中H+的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将5.0g碳酸钙放入一定量稀盐酸中恰好完全反应,得到40mL密度为1.32g/mL的溶液。试计算:
(1)生成标准状况下的二氧化碳气体多少升?(不考虑CO2在水中的溶解)
(2)所得溶液中氯化钙的物质的量浓度。
(3)所用稀盐酸的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学实验小组制备硫酸亚铁铵晶体并设计实验测定其组成,他们进行了以下实验。
Ⅰ.向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到一种浅蓝绿色的硫酸亚铁铵晶体,这种晶体俗名“摩尔盐”,它比绿矾稳定得多。将摩尔盐低温烘干后,称取7.84 g加热至100 ℃失去结晶水,质量变为5.68 g。
Ⅱ.选择图所示的部分装置连接起来,检查气密性后,将上述5.68 g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。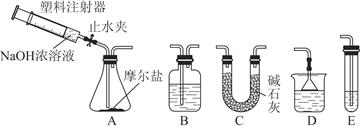
Ⅲ.向A中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。
根据上述实验回答下列问题:
(1)实验Ⅰ中,“一系列操作”依次为________、________和过滤,要检验FeSO4溶液中是否含有Fe3+常用的试剂是________。
(2)实验Ⅱ中,选择的装置是A接________接________(填代号),A装置中未使用分液漏斗的理由是____________________________________________________________
(3)向锥形瓶中加入NaOH溶液的操作方法是_________________________________________________________
吸收A中产生的气体所用试剂应是________;实验小组的同学为保证A中产生的气体被完全吸收,以准确测量其质量,他们在A中反应停止后再进行的操作是__________________________________________________________
(4)根据上述实验数据计算,此摩尔盐中,n(NH4+)∶n(Fe2+)∶n(SO42—)∶n(H2O)=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com