
下列离子方程式书写正确的是 ( )
A.向碳酸氢钠溶液中加入过量的氢氧化钙溶液:2HCO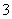 +Ca2++2OH-===CaCO3↓+2H2O+CO
+Ca2++2OH-===CaCO3↓+2H2O+CO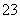
B.向NH4HSO4溶液中逐滴滴入Ba(OH) 2溶液至恰好沉淀完全2OH-+Ba2++2H++SO ===2H2O+BaSO4↓
===2H2O+BaSO4↓
C.向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO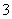 ===3BaSO4↓+2NO↑+H2O
===3BaSO4↓+2NO↑+H2O
D.石灰乳与碳酸钠溶液混合:Ca2++CO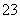 ===CaCO3↓
===CaCO3↓
科目:高中化学 来源: 题型:
下列有关说法正确的是
A. 含有碳元素的化合物一定是有机化合物
B. 生物柴油和柴油的主要成分不同
C. 废弃的可降解高分子材料会造成白色污染
D. 淀粉和纤维素的分子式都可表示为(C6H10O5)n,淀粉和纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
|
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
回答下列问题:
(1)④的元素名称是 ,②在元素周期表中的位置是(周期、族)
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;
(3)①、⑥的简单离子的半径大小关系____________________。(填化学式)
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:
(5)写出⑥最高价氧化物对应水化物跟同周期另一金属元素的最高价氧化物反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2 L的戊烷所含的分子数为0.5NA
B.28 g乙烯所含共用电子对数目为4NA
C.1 mol甲基的电子数目为7 NA
D.现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备1,2-二溴乙烷的反应原理如下:
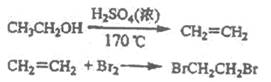
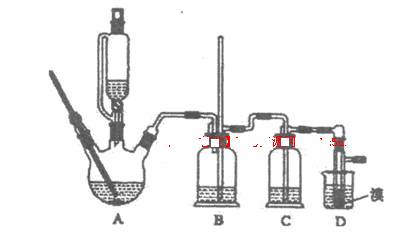
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制各l,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此装置各实验中,要尽可能迅速地把反应温度提高到l70℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该装置各反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量副产物乙醚,可用 的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质或应用的说法,正确的是 ( )
A.制水泥和玻璃都用石灰石做原料
B.利用Al2O3制作的坩埚,可用于熔融烧碱
C.Si可用做太阳能电池和光导纤维的材料
D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。

(1)铋酸钠(不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式______________________。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水
c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有________、________(写化学式)。
(4)理论上(若不考虑物质循环与制备过程中的损失)1 mol MnO2可制得____ mol KMnO4。
(5)该生产中需要纯净的CO2气体。写出实验室制取CO2的化学方程式________,所需气体产生装置是________(选填代号)。
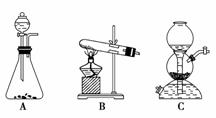
(6)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在________(填性质)上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关碱金属元素性质的叙述中,正确的是 ( )
A.碱金属的单质中,锂的还原性最强
B.K与水反应最剧烈
C.在自然界中它们无游离态存在
D.单质的熔沸点依次升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com