
对盆栽鲜花施用了S-诱抗素制剂可保证鲜花盛开。S-诱抗素的分子结构如下图,
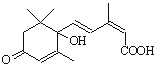
下列关于该物质的说法正确的是 ( )
A.其分子式为C15H22O4
B.1 mol该物质与NaOH溶液反应,最多消耗2 molNaOH
C.既能发生加聚反应,又能发生缩聚反应
D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
科目:高中化学 来源: 题型:
已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。

请回答以下问题:
(1)B的主要用途是______________(填一项),C的化学式为__________。
(2)E中阳离子的结构示意图为____________,CO2的电子式为________________。
(3)向F中通入足量CO2生成K的离子方程式是________________________________
________________________________________________________________________。
(4)J在工业上可用于净水,其原理是__________________________________________ (用离子方程式表示)。
(5)写出H在空气中生成I的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作学习小组讨论辨析以下说法:①冰水混合物和酸雨都是混合物;②水煤气和石油都是可再生能源;③不锈钢和目前流通的硬币都是合金;④稀硫酸和食醋既是化合物又是酸;⑤纯碱和熟石灰都是碱;⑥淀粉溶液和雾都是胶体。上述说法正确的是
A.③④ B.③⑥ C.①③⑤ D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常用FeCl3溶液与铜反应制作印刷电路板。该反应的化学方程式为:
2FeCl3 + Cu = 2FeCl2 + CuCl2 。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
A.0.5mol·L—1 B.1.5 mol·L—1 C.0.4 mol·L—1 D.0.25 mol·L—1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项化学用语中表示正确的是( )
A.Na2O2的电子式为: 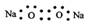
B.丙烷分子的比例模型为: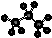
C.甲醛的结构简式:HCHO
D.聚丙烯的结构简式为: 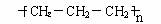
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组欲探究SO2的化学性质,设计了如下实验方案。
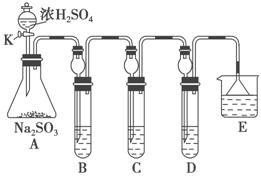
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为_____________________________________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入______ __ ______ | __________ _______ ___ ____ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.两种大气污染物 和
和 在一定条件下可发生如下反应:NO2 + SO2
在一定条件下可发生如下反应:NO2 + SO2 NO + SO3,在体积为VL的密闭容器中通入
NO + SO3,在体积为VL的密闭容器中通入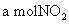 和
和 ,反应后容器内硫原子和氧原子的个数比为( )
,反应后容器内硫原子和氧原子的个数比为( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
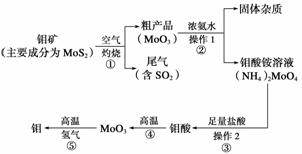
(1)写出反应①的化学方程式:___________________________________________。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂________________________________________________________________________。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有________________________________________________________________________。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为________。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4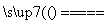 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O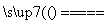 CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________(铜的相对原子质量为96)。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________(铜的相对原子质量为96)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com