
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用如图所示装置进行实验.将CN﹣的浓度为0.2mol•L﹣1的含氰废水100mL与100mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应.打开分液漏斗活塞,滴入100mL稀H2SO4,关闭活塞.
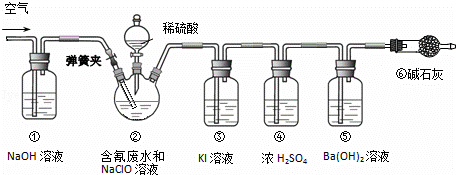
已知装置②中发生的主要反应依次为:
CN﹣+ClO﹣═CNO﹣+Cl﹣;2CNO﹣+2H++3C1O﹣═N2↑+2CO2↑+3C1﹣+H2O
(1)①和⑥的作用是 .
(2)装置②中,生成需由装置③除去的物质的离子方程式为 .
(3)反应结束后,缓缓通入空气的目的是 .
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量.
(5)已知CN﹣的处理效率可高达90%,产生的CO2在标准状况下的体积为 .
| 性质实验方案的设计.. | |
| 专题: | 实验题. |
| 分析: | (1)实验的原理是利用CN﹣+ClO﹣═CNO+Cl﹣;2CNO﹣+2H++3ClO﹣═N2↑+2CO2↑+3Cl﹣+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰; (2)酸性条件下,次氯酸根离子和氯离子反应生成氯气,氯气具有强氧化性,能氧化碘离子生成碘单质; (3)反应结束后,缓缓通入空气,可将生成的二氧化碳全部被吸收; (4)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率; (5)根据处理的CN﹣的物质的量,结合碳元素守恒可知被处理的CN﹣的物质的量为n(CN﹣)=n(CO2),原溶液中CN﹣的物质的量为0.1L×0.2mol/L=0.02mol,据此计算. |
| 解答: | 解:(1)实验的原理是利用CN﹣+ClO﹣═CNO+Cl﹣;2CNO﹣+2H++3ClO﹣═N2↑+2CO2↑+3Cl﹣+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置⑤实验数据的测定产生干扰,装置①和⑥的作用是排除空气中二氧化碳对实验的干扰, 故答案为:排除空气中二氧化碳对实验的干扰; (2)根据已知装置②中发生的主要反应依次为CN﹣+ClO﹣═CNO﹣+Cl﹣、2CNO﹣+2H++3ClO﹣═N2↑+2CO2↑+3Cl﹣+H2O,可知溶液中有氯离子、氢离子和次氯酸根离子,酸性条件下,氯离子和次氯酸根离子反应生成氯气,产生的氯气用碘化钾吸收,所以发生的离子反应方程式为:ClO﹣+Cl﹣+2H+=Cl2↑+H2O, 故答案为:ClO﹣+Cl﹣+2H+=Cl2↑+H2O; (3)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置⑤,以减少实验误差, 故答案为:使装置中残留的二氧化碳全部进入装置⑤; (4)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,则需要测定装置⑤反应前后的质量, 故答案为:装置⑤反应前后质量; (5)根据碳元素守恒可知被处理的CN﹣的物质的量为n(CN﹣)=n(CO2)=0.02mol×90%=0.018mol,所以标准状况下的体积为0.018mol×22.4L/mol=0.4L, 故答案为:0.4L. |
| 点评: | 本题综合考查物质含量的测定的实验设计,以氯气的性质为载体考查化学实验设计和评价问题,题目难度中等,注意把握实验原理和实验方法. |


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
用下图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
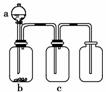
| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | CO2 | 稀盐酸 | CaCO3 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿佛加德罗常数的数值,下列说法正确的是( )
A.等物质的量的H2和N2所含分子数均为nA B.标准状况下,11.2 L的己烷含有分子数为0.5nA
L的己烷含有分子数为0.5nA
C.常温常压下,46gNO2含有原子数 为3nA D.1mol SiO2晶体中含nA个SiO2分子
为3nA D.1mol SiO2晶体中含nA个SiO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
“酸化”是实验中经常采用的方法,下列酸化过程正确的是( )
|
| A. | 抑制Fe2+的水解,用稀硝酸酸化 |
|
| B. | 提高高锰酸钾的氧化能力,用盐酸酸化 |
|
| C. | 确认溶液中含有SO42﹣时,用盐酸酸化,再检验 |
|
| D. | 检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化,再检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生转化,如图所示.有关说法正确的是( )
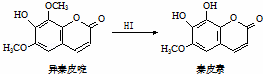
|
| A. | 异秦皮啶与秦皮素互为同系物 |
|
| B. | 异秦皮啶分子式为C11H12O5 |
|
| C. | 秦皮素一定条件下能发生加成反应、消除反应和取代反应 |
|
| D. | 1mol秦皮素最多可与2molBr2、4molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.2-甲基丙烷的一氯取代物有两种
B.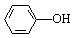 和
和 互为同系物
互为同系物
C.顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同
D.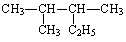 的名称为2-甲基-3-乙基丁烷
的名称为2-甲基-3-乙基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列装置的说法正确的是
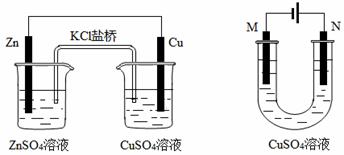
① ②
A.装置①中盐桥内的K+移向CuSO4溶液
B.装置①将电能转变为化学能
C.若装置②用于铁棒镀铜,则N极为铁棒
D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
H2O(g)=H2(g) + 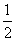 O2(g) △H = +241.8kJ/mol
O2(g) △H = +241.8kJ/mol
H2(g)+ 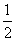 O2(g) = H2O(1) △H = -285.8kJ/mol
O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
A.吸热88kJ B.吸热2.44KJ C.放热44kJ D.吸热44KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度时,向容积为2 L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
A.反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(SO2)=0.0070 mol·L-1,则反应的H>0
D.相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com