
【题目】在两只锥形瓶中分别加入浓度均为l molL-1 的盐酸和NH4Cl溶液,将温度和pH 传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如下图。关于该实验的下列说法,正确的是

A.P点溶液:c(NH4+) + 2c(Mg2+) >c(Cl-)
B.反应剧烈程度:NH4Cl >HCl
C.Q点溶液显碱性是因为MgCl2发生水解
D.1000s后,镁与NH4Cl溶液反应停止
【答案】A
【解析】
浓度均为l molL-1的盐酸和NH4Cl溶液中加入过量的质量、形状均相同的镁条,反应的实质都是Mg+2H+==Mg2++H2↑,从图中可以看出,反应初期,盐酸与镁反应速率快,放出的热量多。反应一段时间后,NH4Cl溶液的pH迅速上升,然后基本恒定;盐酸溶液的pH缓慢上升,当反应时间接近3000s时,pH才迅速上升,然后保持恒定。
A.从图中可以看出,P点溶液的pH>7,此时c(OH-)>c(H+);依据电荷守恒可知,c(NH4+) + 2c(Mg2+)+c(H+)=c(Cl-)+ c(OH-),所以c(NH4+) + 2c(Mg2+) >c(Cl-),A正确;
B.镁与盐酸反应,溶液温度迅速升高,并达最高点,反应放出的热量多,所以反应剧烈程度:HCl >NH4Cl,B不正确;
C.MgCl2水解时,溶液显酸性,所以Q点溶液显碱性不是MgCl2发生水解所致,C不正确;
D.1000s后,镁与NH4Cl溶液反应温度仍在缓慢上升,溶液的pH仍在缓慢增大,说明反应仍在正向进行,D不正确;
故选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是( )
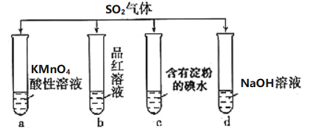
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中蓝色退去,说明还原性:SO2>I-
D.试管d中无明显现象,说明SO2不是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取气体装置一般由发生装置、净化装置、收集装置以及尾气吸收装置组成。以Cl2的实验室制法为例(见下图):
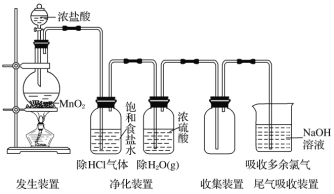
(1)反应原理:用强氧化剂(如KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸。MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)制备装置类型:固体+液体![]() 气体
气体
(3)净化方法:用___________________除去HCl,再用浓硫酸除去水蒸气。
(4)收集方法:________________法或排饱和食盐水法。
(5)尾气吸收:用强碱溶液(如NaOH溶液)吸收,不用Ca(OH)2溶液吸收的原因是_________________________________________________________________________。
(6)验满方法:将湿润的淀粉-KI试纸靠近盛Cl2的试剂瓶口,观察到__________________,则证明已集满;或将湿润的_________________靠近盛Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、氢气是常见能源,燃煤烟气中的氮硫氧化物要污染环境,氢气是一种清洁高效的新型能源,如何消除烟气中氮硫氧化物和经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如图。
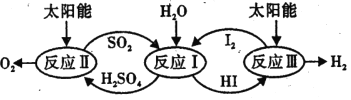
已知:
反应 I:2H2O (1)=2 H2(g) +O2(g) △H1 = +572kJmol-1
反应 II :H2SO4(aq) =SO2 (g) + H2O (l) +![]() O2 ( g) △H2= +327 kJ mol-1
O2 ( g) △H2= +327 kJ mol-1
反应 III:2 HI( aq)=H2 ( g) + I2(g) △H3 =+172k.Jmol-1
则反应SO2 (g)+I2 (g) + 2 H2O (l)=2 HI(aq) + H2SO4 (aq) △H =__________。
(2)用某氢化物 H2 R 高效制取氢气 ,发生的反应为2 H2R(g) ![]() R2(g) +2H2 ( g) 。
R2(g) +2H2 ( g) 。
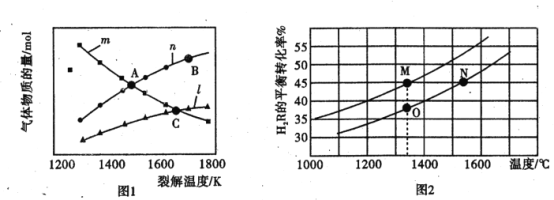
I.若起始时容器中只有H2R, 平衡时三种物质的物质的量与裂解温度的关系如图1。
①图中曲线n 表示的物质是__________(填化学式)。
②C点时,设容器内的总压为p Pa,则平衡常数KP =____________ (用平衡分压代替平衡浓度计算,分压 =总压×物质的量分数)。
II.若在两个等体积的恒容容器中分别加入2.0 mol H 2R、1. 0 molH2R,测得不同温度H2R的平衡转化率如图2 所示。
①M点和O正反应速率v( M) ________v( O) (填“>”“<”或“=”,下同)。
②M 、O 两点容器内的压强P(O)______2 P( M) 。
③平衡常数K( M)_____________K( N)。
(3)以连二硫酸根( S2O42-) 为媒介,使用间接电化学法处理燃煤烟气中的NO, 装置如图所示:
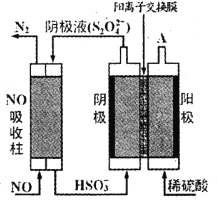
①从 A 口中出来的物质是________________。
②写出电解池阴极的电极反应式________________。
③用离子方程式表示吸收池中除去NO 的原理 ___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前20号元素M、N、R、Q、Z的原子序数依次递增,M与Z、N与Q分别同主族,M、N形成的常见化合物有M2N、M2N2,由该5种元素组成的某结晶化合物X常用作净水剂。下列叙述错误的是( )
A.化合物X中含有离子键和共价键
B.简单离子半径由大到小的顺序为ZRQN
C.N、Q分别与Z形成化合物的水溶液均呈碱性
D.R、Q、Z的最高价氧化物的水化物间能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L的密闭容器中,气体X、Y、Z的物质的量随时间的变化曲线如图所示。
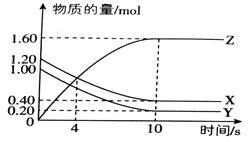
(1)该反应的化学方程式为_________________________.
(2)0~10s内,X的化学反应速率为___________________.
(3)该反应在不同温度下的平衡常数如表所示:
T/℃ | 100 | 220 | 830 | 1000 | 1200 |
K | 45.00 | 32.00 | 1.00 | 0.60 | 0.38 |
则该反应的ΔH__________0 (填“>”、“<”或“=”)
(4)830℃时,在容积为10L的恒容密闭容器中充入5molX气体、7.8molY气体和7.1mol Z气体,此时υ(正)_______υ(逆) (填“>”、“<”或“=”)
(5)上图所示反应的温度为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com