
| A. | 第ⅠA族元素都是金属元素 | |
| B. | 第ⅣA族非金属元素的单质只能形成原子晶体 | |
| C. | 第ⅥA族元素形成的单质,常温下有气、液、固三种状态 | |
| D. | 元素性质呈现周期性变化的根本原因是元素原子最外层电子数呈现周期性变化 |
分析 A、第ⅠA族元素氢是非金属元素;
B、锗、锡、铅是金属晶体;
C、第ⅥA族元素形成的单质,氧气是气态,而S、Se、Te、Po为固体;
D、原子的电子排布决定元素的性质.
解答 解:A、第ⅠA族元素氢是非金属元素,故A错误;
B、锗、锡、铅是金属晶体,并不是原子晶体,故B错误;
C、第ⅥA族元素形成的单质,氧气是气态,而S、Se、Te、Po为固体,无液体,故C错误;
D、原子的电子排布决定元素的性质,即元素的性质呈现周期性变化的根本原因是核外电子排布的周期性变化,故D正确;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表的发现及元素周期律为解答的关键,注重基础知识的考查,题目难度不大.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
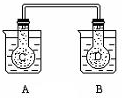 如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )
如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )| A. | 不变 | B. | 烧瓶C中颜色变深,D中变浅 | ||
| C. | 烧瓶D中变深,C中变浅 | D. | 两个烧瓶中的颜色都变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠在火焰上灼烧时使火焰呈黄色,是因为氯化钠发生了分解反应 | |
| B. | 用焰色反应可以鉴别KCl和KNO3 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有K元素,可能有Na元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )| A. | 第二周期零族 | B. | 第三周期ⅡA族 | C. | 第二周期ⅥA族 | D. | 第三周期IIIA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
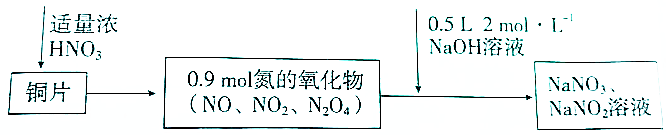
| A. | 若铜片为51.2g.则生成0.2molNaNO3 | |
| B. | 常温下,Cu遇浓硝酸发生钝化.不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16L | |
| D. | 反应过程中生成的Cu(N03)2既是氧化产物,也是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水呈黄绿色,久置的氯水无色 | |
| B. | 新制的氯水漂白作用强,而久置的氯水漂白作用很弱 | |
| C. | 新制的氯水所含成分的种类多,而久置的氯水所含成分的种类较少 | |
| D. | 新制的氯水中无氯离子,而久置的氯水中则含氯离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com