
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 反应产物的总焓大于反应物的总焓时,△H>0 | |
| C. | △H的大小与热化学方程式中的各物质的化学计量数无关 | |
| D. | 在化学反应中,发生物质变化的同时不一定发生能量变化 |
分析 A、放热反应的焓变小于0;
B、反应物总能量高于生成物时,反应放热;
C、△H的数值与化学计量数对应,随化学计量数的改变而改变;
D、化学反应过程就是旧化学键断裂新化学键形成过程,断裂化学键需吸收能量,形成化学键会释放能量.
解答 解:A、△H=Q(生成物的能量和)-Q(反应物的能量和),反应物能量高时△H<0反应放热,反之△H>0反应吸热,故A错误;
B、△H=Q(生成物的能量和)-Q(反应物的能量和),所以△H>0时,反应产物的总焓大于反应物的总焓,故B正确;
C、△H的数值与化学计量数对应,随化学计量数的改变而改变,故C错误;
D、化学反应过程就是旧化学键断裂新化学键形成过程,断裂化学键需吸收能量,形成化学键会释放能量,所以,任何化学反应一定有能量变化,故D错误;
故选B.
点评 本题考查化学反应中能量变化与化学键的关系,以及△H的求算,题目难度不大,注意△H=Q(生成物的能量和)-Q(反应物的能量和).


科目:高中化学 来源: 题型:解答题
| 实验方案(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
(1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
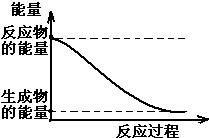 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨是人类科学技术上的一项重大突破,其反应原理为:
合成氨是人类科学技术上的一项重大突破,其反应原理为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R位于元素周期表中的第VA族 | B. | R位于元素周期表中的第 VIIA族 | ||
| C. | RO3-中的R元素只能被还原 | D. | R2在常温常压下一定是气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com