
【题目】1H、2H、3H、H+、H2是( )
A.氢的五种同位素B.五种氢元素
C.氢的五种同素异形体D.氢元素的五种微粒
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有A,B,C,D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p轨道电子数比s轨道电子数少1,C为金属元素且原子核外p轨道电子数和s轨道电子数相等,D元素的原子核外所有p轨道全充满或半充满.
(1)写出C,D两种基态原子核外电子排布图:C;D .
(2)写出B元素单质和氢化物的电子式:单质 , 氢化物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成.某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质.
(1)I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式: Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答: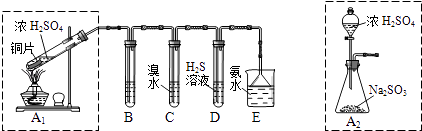
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为;C中反应的离子方程式为 .
(2)为了实现绿色环保的目标,制取SO2装置最好选择 . (A1或A2装置)用氨水吸收尾气中的SO2 , “吸收液”中可能含有OH﹣、SO32﹣、SO42﹣、HSO3﹣等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32﹣、HSO3﹣ , 完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32﹣或 SO42﹣ . |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 . |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.实验室制取乙烯时浓硫酸是催化剂和吸水剂
B.硝基苯制备时浓硫酸作催化剂和脱水剂
C.实验室制备乙烯、硝基苯、苯磺酸时均使用到温度计,且水银球在反应混合物液面以下
D.水浴加热的优点是可以受热均匀且便于控制温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A﹣I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 氧化性最强的单质是 , 还原性最强的单质是 .
(2)最高价氧化物的水化物碱性最强的是 , 酸性最强的是 , 呈两性的是 .
(3)A分别与D,E,F,G,H形成的化合物中,最稳定的 ,
(4)在B,C,E,F,G,H中,原子半径最大的是 ,
(5)A和D组成最简单化合物的电子式 ,
(6)A和E组成化合物的化学式 ,
(7)用电子式表示B和H组成化合物的形成过程: .
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 该温度下此反应的平衡常数K=1.44
B. 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C. 反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
D. 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A,B,C,D,E在元素周期表中的相对位置如图所示,下列说法正确的( ) 
A.原子半径的大小顺序为:rA>rB>rC>rD>rE
B.元素D的最高价氧化物对应的水化物的酸性比E的强
C.A,D两种元素在自然界中都存在相应的单质
D.C的最高价氧化物的水化物与E的最高价氧化物的水化物之间不能发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com