
【题目】某食盐样品中含有少量沙土、氯化钙和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程。

根据流程图回答:
(1)操作Ⅰ的名称是 ,加入的试剂A是 ,沉淀是 ;
(2)写出NaOH与杂质反应的化学方程式 ;
(3)加入试剂B的目的是 ;
(4)蒸发结晶时用到玻璃棒的作用是 。
(5)在粗盐的提纯中,检验SO42-存在的方法___________________________
【答案】
(1)过滤;Na2CO3;CaCO3
(2)2NaOH+MgCl2=Mg(OH)2↓+2NaCl
(3)除去NaOH和Na2CO3
(4)搅拌,防止局部温度过高,造成液滴飞溅
(5)先加入过量的HCl,若无白色沉淀产生,再加BaCl2有白色沉淀产生,则有SO42-离子
【解析】
试题分析:(1)沙土不溶于水,可以通过过滤,将沙土与液体分离开;加入试剂氢氧化钠是为了除去氯化镁,因为氢氧化镁是沉淀,加入试剂A是为了除去氯化钙,由于碳酸钙是沉淀,又不能引入新的杂质,所以加入碳酸钠溶液就行,碳酸钠与氯化钙反应生成碳酸钙沉淀,故答案为:过滤;碳酸钠(Na2CO3);碳酸钙(CaCO3);
(2)反应物是氢氧化钠和氯化镁,生成物是氢氧化镁沉淀和氯化钠,反应的方程式为2NaOH+MgCl2=Mg(OH)2↓+2NaCl,故答案为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(3)前面加入过量的氢氧化钠和碳酸钠会混入溶液中,所以加入试剂B是为了除去过量的氢氧化钠和碳酸钠,故答案为:除去NaOH和Na2CO3;
(4)蒸发结晶时用到玻璃棒的作用是搅拌,防止局部过热导致残留物飞溅,故答案为:搅拌,防止局部过热导致残留物飞溅;
(5)检验SO42-的方法为先加入过量的HCl,若无白色沉淀产生,再加BaCl2有白色沉淀产生,则有SO42-离子,故答案为:先加入过量的HCl,若无白色沉淀产生,再加BaCl2有白色沉淀产生,则有SO42-离子。


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. FeSO4溶液存放在加有少量铁粉的试剂瓶中
B. 将1mol/L的NaCl溶液保存在容量瓶中
C. 凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂
D. 用pH试纸检验某溶液的酸碱性时,一定要先用蒸馏水湿润
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如下转化:
![]() ,下列相关离子方程式或化学方程式错误的是
,下列相关离子方程式或化学方程式错误的是
A. ①可能为AlO2-+H++H2O=Al(OH)3↓
B. ①可能为Fe+2Fe3+=3Fe2+
C. ②可能为2NO+O2=2NO2
D. ②可能为Na2CO3+H2O+CO2=2NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A. SO2的摩尔质量是64g
B. 1 molSO2中所含分子数约为6.02×1023个
C. 1 molSO2的质量是64g/mol
D. 常温常压下,1 molSO2的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.Cl2与稀NaOH溶液反应:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.Fe2(SO4)3和KI溶液反应:Fe3++2I﹣═Fe2++I2
C.烧碱溶液中加入铝片:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
D.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究.

已知废水试样中可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl﹣、SO32﹣、Y、NO3﹣ |
(1)离子X是 (填化学式,下同),离子Y是 .
(2)表中不能确定是否存在的阴离子是 ,能证明该阴离子是否存在的简单实验操作为 .
(3)丁组实验在酸性条件下发生反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化亚铁煅烧得到的烧渣的主要成分为FeO、Fe3O4和Fe2O3等。利用该烧渣制备铁红和副产品无氯钾肥的流程如下:
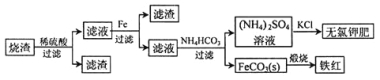
回答下列问题:
(1)煅烧硫化亚铁若生成Fe2O3和SO2,则生成标准状况下11.2L SO2气体,转移电子的物质的量为____________。
(2)该流程中加入铁粉的作用是____________(用离子方程式表示)。
(3)已知四种盐的溶解度随温度变化的曲线如图所示。请回答下列问题:
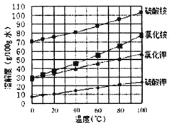
①向滤液II中加入NH4HCO3溶液所发生反应的离子方程式是________________。
②向(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为_________、________、洗涤、干燥等;反应的化学方程式为_______________。
(4)用含少量硫酸亚铁和硫酸铁的硫酸铜溶液制备CuSO4·5H2O的流程如下:
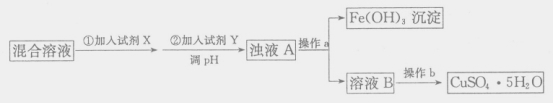
加入试剂X的目的是_____,调节溶液pH的试剂Y可能是_____(填字母编号)。
a.NaOH
b.CuO
c.NH3·H2O
d.Cu(OH)2CO3
Cu2+为0.2mol·L-1的溶液,欲除尽Fe3+(当离子浓度小于1*10-5mol·L-1时,离子已沉淀完全,)调整溶液pH的精确范围是_____(已知:Kap[Cu(OH)2]=2×10-20,Kap[Fe(OH)3]=8.0×10-38,lg2=0.3)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com