解答:解:(1)由C
3H
8(g)→CH
4(g)+HC≡CH(g)+H
2(g)△H
1=+156.6kJ?mol
-1①,
CH
3CH=CH
2(g)→CH
4(g)+HC≡CH(g)△H
2=+32.4kJ?mol
-1 ②,
则根据盖斯定律,反应C
3H
8(g)→CH
3CH=CH
2(g)+H
2(g)可由①-②得到,
所以△H=△H
1-△H
2=+156.6kJ?mol
-1-(+32.4kJ?mol
-1)=+124.2kJ?mol
-1,故答案为:+124.2;
(2)负极通入丙烷,碳元素的化合价升高,电池的正极通入O
2,氧元素的化合价降低,即丙烷与氧气反应生成二氧化碳和水,则电池的总反应为C
3H
8+5O
2═3CO
2+4H
2O,负极电极反应为:C
3H
8+10CO
32--20e
-═4H
2O+13CO
2,原电池中阴离子向负极移动,即CO
32-移向电池的负极,
故答案为:负,C
3H
8+10CO
32--20e
-═4H
2O+13CO
2;负;
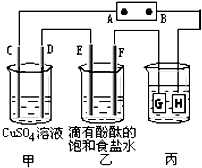
Ⅱ、将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;
(1)B电极是电源的负极,A是电源的正极;
故答案为:正;
(2)C、D、E、F电极发生的电极反应分别为:4OH
-═O
2↑+2H
2O+4e
-、Cu
2++2e
-═Cu、2Cl
-═Cl
2↑+2e
-、2H
++2e
-═H
2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2;
故答案为:1:2:2:2;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,电解质溶液为硝酸银溶液;当乙中溶液的c(OH
-)=0.1mol/L(此时乙溶液体积为500mL)时,根据电极反应2H
++2e
-═H
2↑,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,电解硫酸铜的过程中氢氧根减少,所以氢离子浓度增大,所以酸性增强,甲中溶液的氢离子浓度变大,故答案为:镀件;硝酸银;5.4g;变大;
(4)图甲装置电解CuSO
4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)
2后,恰好使溶液恢复到电解前的浓度.则乙装置中,若不考虑Cl
2的溶解及与碱的反应,甲装置的电解方程式为:2CuSO
4+2H
2O
2H
2SO
4+2Cu+O
2↑,乙中电解饱和食盐水发生的离子方程式为2Cl
-+2H
2O
2OH
-+H
2↑+Cl
2↑;
甲池溶液通电一段时间后,向所得的溶液中加入0.2mol的Cu(OH)
2后恰好恢复到电解前的浓度,发生2CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
4、2H
2O
2H
2↑+O
2↑,由Cu(OH)
2CuO+H
2O,则转移的电子数为(0.2mol×2+0.2mol×2)×N
A=0.8N
A,物质的量为0.8mol,依据电子守恒,主要2mol电子生成1mol氢气和1mol氯气,乙装置共产生气体物质的量共0,8mol,标准状况体积=0.8mol×22.4L/mol=17.92L,
故答案为:17.92.

 (Ⅰ)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(Ⅰ)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).

 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1= CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-, CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,