
下列实验基本操作或说法正确的是 (填写序号)
A、用50ml的量筒量取5.2ml稀硫酸
B、为了有效地除去粗盐中的Ca2+、Mg2+、SO42﹣,可先加入NaOH,再加入BaCl2,最后加入Na2CO3,将沉淀过滤后,再用HCl调整溶液至中性
C、石蕊试纸或PH试纸使用前都应用蒸馏水润湿
D、稀释浓硫酸时,应将水沿器壁缓缓加入浓硫酸中,并不断用玻璃棒搅拌
E、容量瓶中含有少量蒸馏水,对配制一定物质的量浓度的硫酸溶液无影响
F、将饱和FeC13溶液滴加沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体;
G、乙酸乙酯制备收集完毕,分液时,直接将乙酸乙酯从分液漏斗的上口倒出
H、在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒.
考点: 化学实验方案的评价.
分析: A.50ml的量筒精确到1ml;
B.根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
C.pH不能事先湿润;
D.将浓硫酸缓缓加入水中,并不断用玻璃棒搅拌;
E.容量瓶中含有少量蒸馏水,溶质的物质的量不变;
F.制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成.不能用玻璃棒搅拌,防止胶体聚沉;
G.应先放出下层液体;
H.溶解时为加快溶解、过滤时为防止液体外洒、冲破滤纸而引流、蒸发时为防止液体溅出都要使用玻璃棒.
解答: 解:A.50ml的量筒精确到1ml,无法量取5.2ml稀硫酸,故A错误;
B.镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为加过量的NaOH溶液,加过量的BaCl2溶液,加过量的Na2CO3溶液,过滤,加适量的盐酸,故B正确;
C.pH不能事先湿润,以免引起误差,润湿pH试纸相当于稀释了溶液,故C错误;
D.稀释浓硫酸时,不能将水加入浓硫酸,正确方法是将浓硫酸缓缓加入水中,并不断用玻璃棒搅拌,故D错误;
E.容量瓶中含有少量蒸馏水,溶质的物质的量不变,则浓度不变,故E正确;
F.制备氢氧化铁胶体时,选用氯化铁饱和溶液,若氯化铁浓度过低,不利于氢氧化铁胶体的形成不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故F错误;
G.应先放出下层液体,再倒出上层液体,故G错误;
H.在粗盐溶解过程中,用玻璃棒搅拌,加速食盐溶解;在过滤时,用玻璃棒引流;在蒸发过程中,用玻璃棒搅拌,使液体均匀受热,防止液体飞溅,故H正确.
故答案为:BEH.
点评: 本题考查化学实验方案的评价,综合考查物质的性质、分离、提纯、制备等知识,侧重于学生的实验能力和评价能力的考查,难度不大,注意把握实验的操作方法和注意事项.


科目:高中化学 来源: 题型:
已知Q与R的摩尔质量之比为9:22,在反应X+2Y═2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量 之比为()
之比为()
A. 46:9 B. 32:9 C. 23:9 D. 16:9
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式表示正确的是()
A. 澄清石灰水中通入过量二氧化碳:OH﹣+CO2═HCO3﹣
B. 铜片跟三氯化铁溶液反应:Fe3++Cu═Cu2++Fe2+
C. 漂白粉溶液中通入少量SO2:Ca2++2ClO﹣+SO2+H2O═CaSO3↓+2HClO
D. Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Cl﹣、Fe2+、H2O2、I﹣、SO2均具有还原性,且在酸性溶液中的还原性依次增强.下列各反应不可能发生的是()
A. 2Fe2++Cl2═2Fe3++2Cl﹣
B. 2Fe3+十SO2十2H2O=2Fe2+十SO42﹣十4H+
C. H2O2十H2SO4=SO2↑十O2↑十2H2O
D. SO2十I2十2H2O=H2SO4十2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应最终能生成Fe3+的化合物的是()
①过量Fe与HNO3
②铁丝在硫蒸汽中燃烧
③向FeBr2溶液中通入Cl2
④铁与CuCl2溶液反应
⑤Fe(OH)2露置于空气中.
A. ①②③ B. ①③⑤ C. ③④ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是 ,该反应的化学方程式是 .
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是NO.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是 mol.
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是()
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的化学物质,在生产生活中有重要的应用.试回答下列问题:
实验室制备氯气的化学方程式为MnO2+4HCl(浓)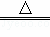 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)将氯气通入紫色石蕊试液中可观察到的现象是 请结合化学方程式和必要的文字描述解释其中的原因 ,;
(2)若该实验中有87g MnO2完全反应,产生的Cl2在标准状况下的体积为多少升?(写出计算步骤)
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钠与CO2作用,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2.当0.2mol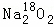 与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是( )
与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是( )
选项 Na2CO3的质量 关于O2的描述
A 21.2g O2的摩尔质量是36g•mol﹣1
B 21.6g 生成标准状况下O2的体积为2.24L
C 21.6g O2的摩尔质量是34g•mol﹣1
D 22.4g 生成标准状况下O2的体积
为2.24mL
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com