
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
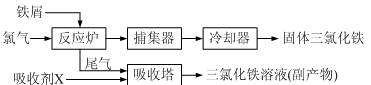
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
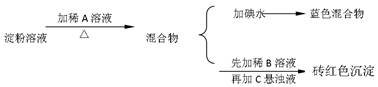
科目:高中化学 来源:不详 题型:实验题
 (一)甲组:实验方案:镁铝合金
(一)甲组:实验方案:镁铝合金 测定剩余固体质量
测定剩余固体质量 盘天平称量一定质量镁铝合金粉末
盘天平称量一定质量镁铝合金粉末 (二)乙组:实验方案:镁铝合金
(二)乙组:实验方案:镁铝合金 测定生成气体的体积
测定生成气体的体积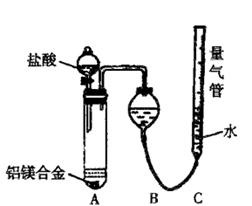

 并最终得到固体物质1.45g。则该合金中铝的质量分数为 。
并最终得到固体物质1.45g。则该合金中铝的质量分数为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
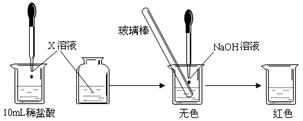
| 滴定次数 | 盐酸的体积/mL | NaOH溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 固体试剂A | 液体试剂B |
| ① | | |
| ② | | |
| ③ | | |
| ④ | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
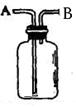

 按下列要求回答问题:
按下列要求回答问题:











 (1)用该装置收集氢气,气体从进入;(填A、B,下同)
(1)用该装置收集氢气,气体从进入;(填A、B,下同)
 收集一氧化氮,先将瓶子注满水,塞紧瓶塞,气体从进入,
收集一氧化氮,先将瓶子注满水,塞紧瓶塞,气体从进入, (2)用该装置除去混在氯气中的氯化氢,广口瓶应装溶液,混合气从
(2)用该装置除去混在氯气中的氯化氢,广口瓶应装溶液,混合气从 进入;
进入; (3)用该装置测量O2的体积时,将广口瓶注满水后,塞紧瓶塞,O2从进入,与带导管的量筒相接。
(3)用该装置测量O2的体积时,将广口瓶注满水后,塞紧瓶塞,O2从进入,与带导管的量筒相接。 (4)医院
(4)医院 里用盛蒸馏水的该装置连接氧气瓶与病人,接氧气瓶,与病人相接。
里用盛蒸馏水的该装置连接氧气瓶与病人,接氧气瓶,与病人相接。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有①② | B.只有①③④ | C.只有③④ | D.①②③④ |
查看答案和解析>>
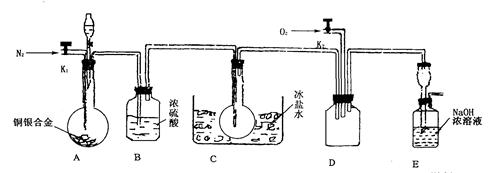
科目:高中化学 来源:不详 题型:实验题
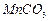 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以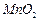 为原料制备少量高纯
为原料制备少量高纯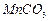 的操作步骤如下:
的操作步骤如下: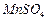 溶液:
溶液: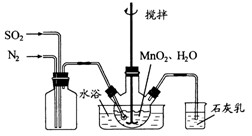
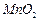 和水,搅拌,通入
和水,搅拌,通入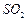 和
和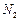 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入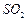 ,继续反应片刻,过滤(已知
,继续反应片刻,过滤(已知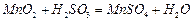 )。
)。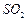 尽可能转化完全,在通入
尽可能转化完全,在通入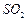 和
和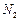 比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。
比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。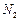 换成空气,测得反应液中
换成空气,测得反应液中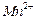 、
、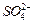 的浓度随反应时间t变化如下图。导致溶液中
的浓度随反应时间t变化如下图。导致溶液中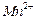 、
、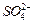 浓度变化产生明显差异的原因是 。
浓度变化产生明显差异的原因是 。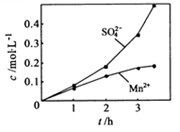
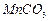 固体:已知
固体:已知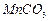 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;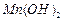 开始沉淀时
开始沉淀时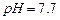 。请补充由(1)制得的
。请补充由(1)制得的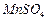 溶液制备高纯
溶液制备高纯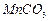 的操作步骤[实验中可选用的试剂:
的操作步骤[实验中可选用的试剂: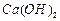 、
、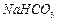 、
、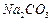 、
、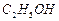 ]。
]。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com