

| y |
| 4 |
| 2×5+2-8 |
| 2 |
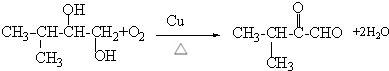
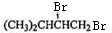 ,F在NaOH水溶液、加热条件下发生水解反应生成G为
,F在NaOH水溶液、加热条件下发生水解反应生成G为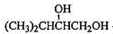 ,G与
,G与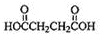 发生酯化反应生成H,结合H的分子式可知H为
发生酯化反应生成H,结合H的分子式可知H为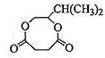 ,据此解答.
,据此解答.| y |
| 4 |
| 2×5+2-8 |
| 2 |
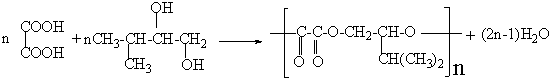
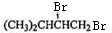 ,F在NaOH水溶液、加热条件下发生水解反应生成G为
,F在NaOH水溶液、加热条件下发生水解反应生成G为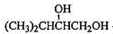 ,G与
,G与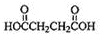 发生酯化反应生成H,结合H的分子式可知H为
发生酯化反应生成H,结合H的分子式可知H为 ,
,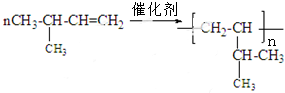 ,
,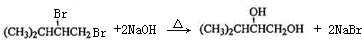 ,
,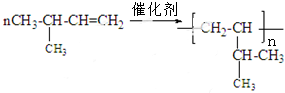 ;
;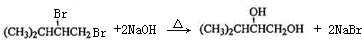 ;
;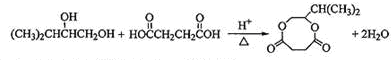 ,
, ,
,
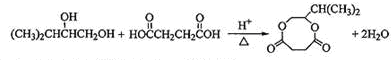 ,
,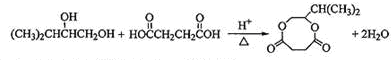 ;
; ;
; ;
; ,故答案为:
,故答案为: .
.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水电离:NH3?H2O=NH4++OH- |
| B、碳酸钙电离:CaCO3?Ca2++CO32- |
| C、硫酸铝水解:Al3++2H2O=Al(OH)3↓+3OH- |
| D、AgCl的沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3的分解率为20% |
| B、10min内用O2表示的该反应的反应速率为0.005mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、达到平衡时分解的Ag2SO4固体为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
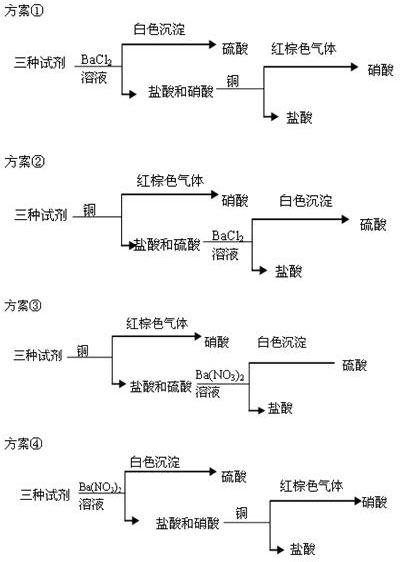
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A是石油裂解气的主要成分,A的产量通常衡量一个国家的石油化工水平;现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知A是石油裂解气的主要成分,A的产量通常衡量一个国家的石油化工水平;现以A为主要原料合成乙酸乙酯,其合成路线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com