
(2013?郑州一模)在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应平衡常熟与温度的关系如下表,则( )
|
| 0.5 |
| 0.54 |


科目:高中化学 来源: 题型:
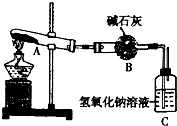 (2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示. (2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示.
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com