
【题目】下列分离提纯所选用的试剂正确的是( )
A.除去O2中混有的N2:选用灼热的铜网
B.提取碘水中的碘单质:选用有机试剂苯
C.除去CO2中混有的CO:选用适量澄清石灰水
D.除去Mg粉中混有的MgO:选用过量稀盐酸
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
A. υ(D)="0.4" mol / (L·s) B. υ(C)="0.5" mol / (L·s)
C. υ(B)="0.6" mol / (L·s) D. υ(A)="0.15" mol / (L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于物质的类别,下列说法正确的是( )
A.食盐水、糖水、冰水都属于混合物
B.烧碱、火碱、消石灰都属于碱
C.KHSO4、HCl、HNO3在水中都能电离出氢离子,都属于酸
D.溶液、胶体、浊液都属于稳定的分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
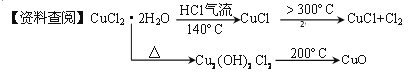

请回答下列问题:
(1)仪器X的名称是__________。
(2)实验操作的先后顺序是① → → → → ⑤。
①检查装置的气密性后加入药品
②熄灭酒精灯,冷却
③在“气体入口”处通干燥HCl
④点燃酒精灯,加热
⑤停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生反应的离子方程式是 。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
(6)若已证实杂质为CuO,请写出由Cu2(OH)2Cl 2生成CuO的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程能用勒夏特列原理解释的是 ( )
A.工业合成氨中选择高温条件下进行
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO2的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸 分子式:HCl 相对分子质量:36.5 密度约1.18 g·mL-1 HCl的质量分数:36.5% |
(1)该盐酸的物质的量浓度= ,从中取出100ml,所含HCl的物质的量为 ,所含Cl-的质量为 。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中C(HCl)= ,从中取出10ml,其浓度为 。
(3)取稀释后的盐酸与足量锌粒作用,生成是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示, K值大小与温度的关系是:温度升高,K值 。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g) ![]() CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
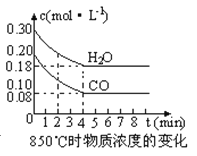
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于 状态;c 1数值 0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 (单选),表中5min~6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用来解释下列事实的离子方程式正确的是
A.钢铁发生吸氧腐蚀的正极反应:O2+4e—+2H2O=4OH—
B.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe(OH)3+3H2O
C.用铜为电极电解饱和食盐水:2Cl—+2H2O![]() Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH—
D.碳酸氢钠溶液中加入过量石灰水:HCO3—+OH—=CO32—+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com