
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | 2HCl+Zn═ZnCl2+H2↑ | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子 | |
| C. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3 NA | |
| D. | 常温下,1L 0.1 mol•L-1的Na2CO3溶液中含有的离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
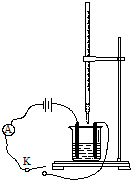 如图,向碱式滴定管和烧杯中分别注入0.2mol•L-1Ba(OH)2溶液和0.1mol•L-1稀硫酸各50mL,并向稀硫酸中滴加几滴石蕊溶液,按如图装置连接好.
如图,向碱式滴定管和烧杯中分别注入0.2mol•L-1Ba(OH)2溶液和0.1mol•L-1稀硫酸各50mL,并向稀硫酸中滴加几滴石蕊溶液,按如图装置连接好.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的同分异构体,其分子中有两个官能团,能发生银镜反应,能被酸性KMnO4溶液氧化成G( C2H4O2)和芳香化合物H(C8H6O4),G和H与碳酸氢钠溶液反应均能放出CO2气体,H芳环上的一硝化产物只有一种.
)的同分异构体,其分子中有两个官能团,能发生银镜反应,能被酸性KMnO4溶液氧化成G( C2H4O2)和芳香化合物H(C8H6O4),G和H与碳酸氢钠溶液反应均能放出CO2气体,H芳环上的一硝化产物只有一种. ;
; +2Cu(OH)2$\stackrel{△}{→}$HOOC
+2Cu(OH)2$\stackrel{△}{→}$HOOC +Cu2O↓+2H2O;
+Cu2O↓+2H2O; +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
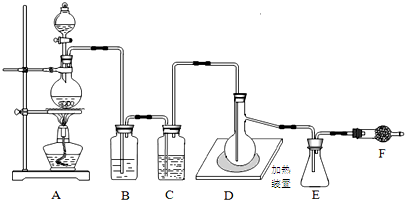
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
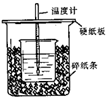 50mL0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式: ;
;
 ,属于酚类结构的同分异构体有3种.
,属于酚类结构的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g SO2含有氧原子数为NA | |
| B. | 1 mol铁与足量稀盐酸反应转移的电子数目为3 NA | |
| C. | 在同温同压下,相同体积的任何气体单质应含有相同的原子数 | |
| D. | 常温常压下,14 g N2含有分子数为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com