
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g) nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:

下列说法正确的是
A.m>nB.Q<0
C.温度不变,压强增大,Y的质量分数减少D.体积不变,温度升高,平衡向逆反应方向移动
【答案】C
【解析】
A. 容器的体积可变,说明该容器为恒压装置;在温度相同的条件下,气体体积扩大到原来的两倍时,Y的浓度本该降低为0.5mol·L-1,但实际上为0.75 mol·L-1,说明平衡正向移动,由于是恒压,气体体积增大,根据阿伏加德罗定律,平衡正向移动,说明正反应方向是气体物质的量增多的方向,即m<n,A错误;
B. 气体体积不变时,温度升高,Y的浓度增大,说明平衡向正反应方向移动,则说明正反应是吸热反应,即Q>0,B错误;
C. 温度不变,压强增大,平衡向气体体积减小的方向移动,由于m<n,所以平衡逆向移动,则Y的质量分数减小,C正确;
D. 体积不变,温度升高,平衡向吸热方向进行,由于正反应是吸热反应,所以平衡正向移动,D错误;
故合理选项为C。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】室温下,向20.00mL 0.1000mol·L1盐酸中滴加0.1000mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5,邻苯二甲酸为弱酸。下列说法不正确的是( )
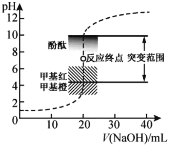
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用酸式滴定管量取20.00mL 0.1000mol·L1盐酸时,酸式滴定管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钠标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00mL 时,pH约为1.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1.00mol NaCl中含有6.02×1023个NaCl分子
B. 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C. 欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D. 电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铁与稀硝酸反应产生一氧化氮,某校兴趣小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去)。B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;F为一个空的蒸馏烧瓶;E是用于鼓入空气的双连打气球。
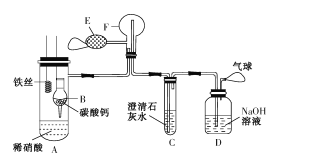
回答下列问题:
(l)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,一段时间后,C中澄清石灰水____(填现象)时,将B装置上提,使之与稀硝酸分离。
(2)将A中铁丝放入稀硝酸中,装置A中产生________(填“无色”或“红棕色”)气体。用E向F中鼓入空气后,烧瓶F内发生反应的化学方程式为 ___, 一段时间后,C中的现象为____。
(3)若反应后向A中溶液滴加KSCN溶液,溶液不变红色,则铁丝与稀硝酸反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol![]() 和2mol
和2mol![]() ,开始时容器的体积均为VL,发生如下反应并达到平衡状态
,开始时容器的体积均为VL,发生如下反应并达到平衡状态![]() 提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)![]() aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是![]()
![]()
Ⅰ Ⅱ
Ⅱ Ⅲ
Ⅲ
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ;②
;②![]() ;③
;③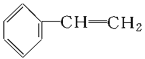 ;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦
;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦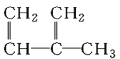 ;⑧
;⑧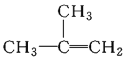
A.④和⑧B.①②和③C.⑦和⑧D.④⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为九种主族元素在周期表中的位置:
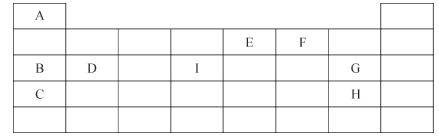
请回答下列问题:
(1)I元素的位置是第 ________周期,第______族。
(2)C、B、D 三种元素的金属性由强到弱的顺序为___________________(填元素符号)。
(3)E、F两种元素对应的最简单氢化物的稳定性:________________ (填化学式)。
(4)C的单质与稀盐酸反应的离子方程式为_________________________ 。
(5)G 的单质气体通入H、C形成化合物的水溶液中,写出该反应的化学方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3,还含有硅、铝等杂质。制备流程如图所示:
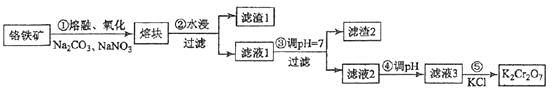
回答下列问题:
⑴步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4 + Fe2O3 + CO2+ NaNO2
Na2CrO4 + Fe2O3 + CO2+ NaNO2
上述反应配平后FeOCr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________(可用化学方程式表示)。
⑵步骤④调滤液2的pH使之变_________(填“大”或“小”),原因是_________(用离子方程式表示)。
⑶有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到10℃得到的K2Cr2O7固体产品最多,步骤⑤的反应类型是___________________。
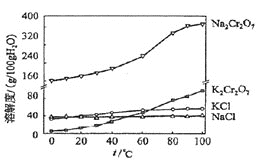
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列两个热化学方程式,回答下列问题:
2H2(g)+O2(g)![]() 2H2O(1) ΔH=571.6 kJ · mol1
2H2O(1) ΔH=571.6 kJ · mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
3CO2(g)+4H2O(l) ΔH=2 220 kJ · mol1
(1)H2的燃烧热为_______,C3H8的燃烧热为_______。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(3)现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com