
下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是( )
|
| A. | H2(g)+Cl2(g)=2HCl(g);△H=﹣184.6kJ/mol |
|
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=﹣802.3kJ/mol |
|
| C. | 2H2(g)+O2(g)=2H2O(l);△H=﹣571.6kJ/mol |
|
| D. | CO(g)+ |
考点:
燃烧热.
专题:
化学反应中的能量变化.
分析:
从燃烧热的定义分析,燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量.
解答:
解:A、氢气与氯气反应不是与氧气反应,燃烧热是指与氧气反应,热化学方程式中△H不等于燃烧热,故A错误;
B、燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,故B错误;
C、热化学方程式中H2的物质的量不为1mol,热化学方程式中△H不等于燃烧热,故C错误;
D、符合燃烧热的定义,热化学方程式中△H代表燃烧热,故D正确.
故选D.
点评:
本题考查燃烧热的定义,题目难度不大,注意燃烧热概念的理解.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
|
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 |
|
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
|
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 |
|
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应mA(g)+nB(g)⇌pC(g)+qD(g) 满足下列图象,根据图象判断四种关系正确的是( )
|
| A. | m+n>p+q,正反应吸热 | B. | m+n<p+q,正反应放热 |
|
| C. | m+n>p+q,正反应放热 | D. | m+n<p+q,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
阅读下列实验内容,根据题目要求回答问题.
某学生为测定未知浓度的硫酸溶液,实验如下:以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
(1)该学生用标准0.14mol•L﹣1NaOH溶液滴定硫酸的实验操作如下:
A、检查滴定管是否漏水
B、用蒸馏水洗干净滴定管
C、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2﹣3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
D、用待测定的溶液润洗酸式滴定管
E、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂.
F、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G、另取锥形瓶,再重复操作一次
①该滴定操作中应选用的指示剂是 ;
②在F操作中如何确定终点? .
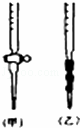
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (选填“甲”或“乙”)中.
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) .
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度和压强不变时,1LNO2高温分解(2NO2⇌2NO+O2),达到平衡时体积变为1.2L,这时NO2的转化率为( )
|
| A. | 40% | B. | 20% | C. | 60% | D. | 5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
稀的醋酸溶液中存在平衡CH3COOH⇌CH3COO﹣+H+(正方向吸热),要使溶液中c(H+)减小,下列操作正确的是( )
|
| A. | 溶液中加入氢氧化钠固体 | B. | 溶液中通入HCl气体 |
|
| C. | 使醋酸溶液的温度升高 | D. | 加入纯醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)⇌CO(g)+Cl2(g);△H>0.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
|
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素 X、Y、Z 可组成化学式为 XYZ3 的四种化合物甲、乙、丙、丁.
(l)若甲中 X 的原子只有一个质子,Y、Z同周期,画出Z的电子排布图为 .
(2)若乙中X、Y、Z 三种元素的原子序数之和为 26,Y、Z 同周期,且乙是一种微溶于水的盐,并写出工业制备单质X的化学方程式: .
(3)若丙中X元素的焰色反应为黄色,Y与X同周期,Y 是同周期中原子半径最小的元素,丙与浓盐酸反应生成 Y 单质的化学方程式为 .
(4)若丁中 X、Y、Z 处于不同周期,X的族序数是周期序数的二倍,Z原子核外电子占有9个轨道,且具有一个未成对电子,则丁的结构式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com