
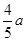 ,故平衡常数K
,故平衡常数K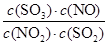 =
=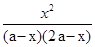 =
=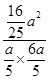 ≈2.67,
≈2.67,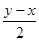 =
=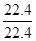 mol;
mol;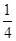 ,y=
,y=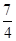 ;即一氧化氮和二氧化氮的物质的量之比
;即一氧化氮和二氧化氮的物质的量之比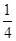 :
: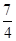 =1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,故答案为:1:7.
=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,故答案为:1:7.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:不详 题型:实验题
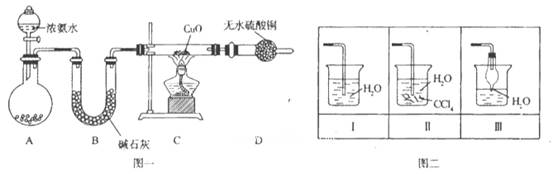
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜片完全消耗时所用的时间 | B.反应中转移的电子总数 |
| C.反应所消耗硝酸的物质的量 | D.反应生成气体的体积(标准状况) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 | B.0.12 | C.0.15 | D.0.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
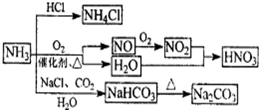
| A.NH4Cl和NaHCO3都是常用的化肥 |
| B.NH4Cl、HNO3和Na2CO3受热时都易分解 |
| C.NH3和NO2在一定条件下可发生氧化还原反应 |
| D.图中所涉及的盐类物质均可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3 | B.Ba(NO3)2 | C.Na2SO4 | D.KCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com