
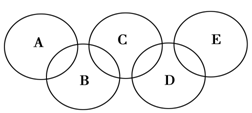
 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:

 ;故答案为:
;故答案为: ;
;

科目:高中化学 来源:2013-2014学年高考化学三轮复习排查 专题1物质的组成性质分类化学用语练习卷(解析版) 题型:填空题
2014年全运会在辽宁举办,其开幕式就是一场焰火盛宴。
(1)焰火利用了部分金属元素特征的??????? 反应,该反应属于??????? (填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素。
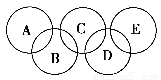
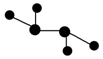
图中A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E分子结构的球棍模型为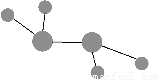 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为??????????????? ,D的化学式是??????? 。
②A、B、E中均含有的一种元素符号为??????? 。
③C与纯碱反应的化学方程式为????????????????????????????????????????? 。
④液态B与液态E反应可生成一种单质和一种常见液体,1 mol B参加反应放出热量Q kJ,其反应的热化学方程式为????? ????????????????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
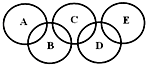 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为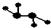 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题

 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题: 查看答案和解析>>
科目:高中化学 来源:2011-2012学年贵州省遵义市仁怀市育英实验学校高二(下)期末化学试卷(解析版) 题型:填空题
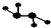 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: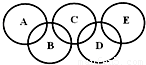
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com