
| A. | 铁元素被氧化,碳元素被还原 | |
| B. | 当有1mol O2参与反应时,消耗$\frac{2}{3}$mol Fe | |
| C. | x=4,y=3 | |
| D. | 每生成1mol FeCO3,转移电子4mol |
分析 2Fe+xC+yO2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCO3,反应中铁元素化合价0价变化为+2价,碳元素化合价0价变化为+4价,氧元素化合价0价变化为-2价,氧气做氧化剂被还原,铁、碳做还原剂被氧化,依据氧化还原反应原子守恒、电子守恒计算xy和电子转移总数,结合化学方程式定量关系计算各物质的量.
解答 解:A.反应中铁元素化合价0价变化为+2价,碳元素化合价0价变化为+4价,氧元素化合价0价变化为-2价,氧气做氧化剂被还原,铁、碳做还原剂被氧化,故A错误;
B.原子守恒得到x=2,y=3,则1molO2参与反应时,消耗Fe物质的量$\frac{2}{3}$mol,故B正确;
C.原子守恒得到x=2,y=3,故C错误;
D.依据化学方程式中元素化合价变化计算每生成2molFeCO3,电子转移总数12mol,则生成1mol FeCO3,转移电子6mol,故D错误;
故选B.
点评 本题考查了氧化还原反应的概念、电子转移计算,主要是原子守恒、电子守恒的计算应用,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | “物质的量”的单位是g.mol-1 | |
| B. | 22.4LN2所含分子数NA | |
| C. | 0.1mol铁与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 0.1mol CO2中所含氧原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
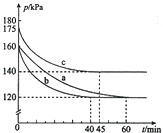 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•3H2O | B. | CuSO4•2H2O | C. | CuSO4•H2O | D. | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4和NaHSO4都属于酸 | B. | 火碱和纯碱都属于碱 | ||
| C. | KOH和NH3•H2O都属于电解质 | D. | Na2O和Na2O2都属于碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
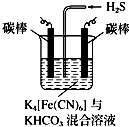 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com