
【题目】下列反应既属于非氧化还原反应,又属于吸热反应的是( )
A.高温下炭与CO2的反应
B.Ba(OH)28H2O与NH4Cl的反应
C.生石灰溶于水的反应
D.盐酸与烧碱溶液的中和反应
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,按要求作答: 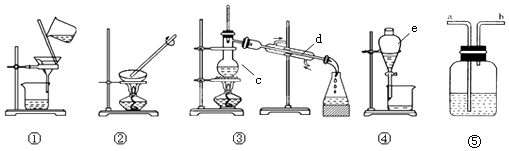
(1)装置中c、d、e的名称分别为、、
(2)分离下列物质,需要在哪套装置中进行 Ⅰ.干燥H2 , 可采用(填装置序号)装置
Ⅱ.除去食盐溶液中的水,可采用(填装置序号)装置
Ⅲ.淡化食盐水,可采用(填装置序号)装置
Ⅳ.实验室中的石灰水久置,液面上常悬浮有CaCO3微粒.可采用(填装置序号)装置除去Ca(OH)2溶液中悬浮的CaCO3微粒
Ⅴ.分离碘水中的碘应先选择装置(填装置序号) 进行和操作,再用装置(填装置序号)进行操作.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备。

已知:①2NO+Na2O2=2NaNO2; ②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______________。
(2)装置A中发生反应的化学方程式为__________________________________。实验结束后,将B瓶中的溶液经蒸发浓缩、__________(填操作名称)、过滤可获得CuSO4·5H2O。
(3)仪器C的名称为______________,其中盛放的药品为 ____________(填名称)。
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,________________,则产物是NaNO2(注明试剂、现象)。
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①第一组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在原电池中,通常较活泼的金属做_____极,发生_______反应;
电解池中,与电源正极相连的极是_______极,发生________反应。
(2)下图所示水槽中试管内有一枚铁钉,放置数天后观察:

①若试管内液面上升,发生_____腐蚀,正极反应式为________________。
②若试管内液面下降,发生_______腐蚀,正极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小粒金属钠放在燃烧匙里加热,实验现象有下列描述:
①金属钠先熔化②在空气中燃烧,产生紫色火焰③燃烧后生成白色固体④燃烧时火焰呈黄色⑤燃烧后生成淡黄色固体物质,其中描述正确的是
A. ①② B. ①②③ C. ①④⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
选项 | 碱 | 酸 | 盐 | 酸性氧化物 |
A | 苏打 | 硫酸 | 小苏打 | 二氧化硫 |
B | 苛性钠 | 碳酸 | 胆矾 | 一氧化氮 |
C | 烧碱 | 硝酸 | 石灰石 | 二氧化硅 |
D | 纯碱 | 醋酸 | 碘化钾 | 一氧化碳 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在生活及生产中有很多重要用途。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)基态碳原子价电子的电子轨道表达式为____,第一电离能Ga____As(填“>”、 “<”、“=”)。
(2)BN和GaAs都是原子晶体,它们的硬度和熔点BN>GaAs,原因是________________。
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。 (CN)2分子中氮原子的轨道杂化类型为_____,σ 键与 π 键数目之比为_______; (SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S),其原因是_________。
(4)①卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为_____________;②一定条件下(SCN)2可氧化为CO32—和SO32—等离子,其中SO32—的立体构型为_________。
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),CaC2 晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。写出与C22﹣互为等电子体的微粒符号________、_______;此晶体中 1 个 C22﹣周围距离最近的Ca2+为______个;若该晶胞的边长为a、a、b(nm),则该晶体的密度为______ g·cm-3(写出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对某金属冶炼技术的掌握程度决定了其应用的广泛性。影响冶炼方法的主要因素是
A.金属的活动性大小 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的导电性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是高中化学重点学习大三大气体之一,是常见的大气污染物之一,同时有是重要的工业原料,探究其制备方法和性质具有非常重要的意义,请回答下列问题。
Ⅰ.某研究小组将纯净的SO2气体通入0.5mol/L的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
①请在下表空白处填写相关实验现象。
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ | 假设一成立 |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ |
②设计实验1的目的是_________。
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图甲所示。实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
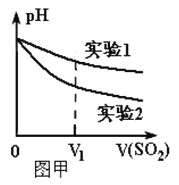
Ⅱ.我国规定空气中SO2含量不得超过0.02mg/L。某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

(1)若原料气从左向右流时,上述装置连接的顺序是:原料气→______ (用字母和箭头表示)。当装置②中出现_______现象时,立即停止通气。
(2)你认为下列试剂中,可以用来代替试管中的酸性KMnO4溶液的是________。(填字母代号)
A.NaOH溶液 B.溴水 C.氨水 D.BaCl2溶液
Ⅲ.中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行定性测定。
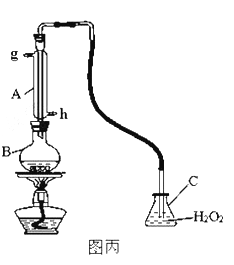
(1)B中加入250.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0900mol/L NaOH标准溶液进行滴定,滴定终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g/L。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com