
| 1 |
| 2 |
| ��H1-��H2 |
| 2 |
| ��H1-��H2 |
| 2 |


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��̼�������Һ�м������������������Һ��Ca2++2HCO3-+2OH-=CaCO3��+CO32++2H2O |
| B���ð�ˮ���չ����Ķ������� NH3?H2O+SO2=NH4++HSO3- |
| C�����������Һ��ͨ�˹���������̼��Ca2++2ClO-+H2O+CO2=CaCO3��+2HClO |
| D���Ȼ�������Һ�м������2Fe2++4H++NO3-=2Fe3++2H2O+NO�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
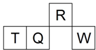 ������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������T��������������������������ȣ������жϲ���ȷ���ǣ�������
������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������T��������������������������ȣ������жϲ���ȷ���ǣ�������| A��RԪ�ص������̬�⻯�K������ˮ |
| B������������Ӧˮ��������ԣ�W��Q |
| C��ԭ�Ӱ뾶��T��R |
| D����TԪ�ص�����Һһ���Լ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| A��172.5 kJ |
| B��1 149 kJ |
| C��283 kJ |
| D��566 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��CH3OH��l��+
| ||
| B��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��l������H=-1452KJ?mol-1 | ||
| C��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��l������H=+725.8KJ?mol-1 | ||
| D��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��l������H=+1452KJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NH4HCO3������ķ�Ӧ�Ƿ��ȷ�Ӧ |
| B���÷�Ӧ�У�����ת��Ϊ�����ڲ������� |
| C����Ӧ�������������������������� |
| D����Ӧ���Ȼ�ѧ����ʽΪNH4HCO3+HCl-��NH4Cl+CO2��+H2O��H=+Q kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
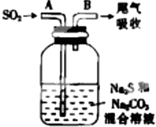 ���ȼ��仯�����ɹ㷺����;��
���ȼ��仯�����ɹ㷺����;��| ���ϣ�25�� H2CO3 Kal=4.4��10-7 H2S Kal=1.3��10-7 H2SO3 Kal=1.54��10-2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢ� | B���ڢۢܢ� |
| C���ۢ� | D���ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com