
FeCl3在现代工业生产中应用广泛。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。工业上,向500—600℃的铁屑中通入氯气可 生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。
生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。
某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,

请回答下列问题:
(1)装置的连接顺序为 (用a、b、c…h表示)。
(2)i.E中饱和食盐水的作用是 。
ii.D中碱石灰的作用是 。
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得FeCl3进入收集器,需进行的操作是 。
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是 (用离子方程式表示)。
(5)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明 ;
实验②的目的是 ;
得出结论: 。
科目:高中化学 来源:2015-2016学年重庆市高二阶段测理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A. 在100ml 1mol·L-1的Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B. 在100ml 2mol·L-1的FeI2的溶液中通入标况下5.6L的Cl2:4Fe2++6I-+5Cl2=4Fe3++3I2+10Cl-
C. 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D. AlCl3溶液中加入过量的NaOH溶液:Al3++4OH-=AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源:2017届湖北省枣阳市高三上学期8月月考化学试卷(解析版) 题型:选择题
将过量的CO2分别通入①CaC12溶液;②Na2SiO3溶液;③Ca(C1O)2溶液;④饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是
A.①②③④ B.②④ C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源:2017届贵州省遵义市高三上第一次月考化学试卷(解析版) 题型:填空题
某有机物的结构简式如下:
HO—CH2—CH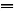 CH—CH
CH—CH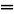 CH—CH2—COOH
CH—CH2—COOH
(1)该有机物含有的官能团的名称是 。
(2)验证该有机物中含有“—COOH”,常采用的试剂是 ,产生的现象为 。
(3)对该有机物的性质描述正确的是 。
A.与金属Na反应放出O2
B.与Cl2只能发生加成反应,不能发生取代反应
C.1 mol该有机物可与2 mol NaOH反应
D.一定条件下能与H2发生加成反应
(4)1 mol该有机物完全与溴水发生加成反应时,需要Br2 mol。
(5)请选择适当试剂,检验该有机物分子中含有醇羟基,并写出实验方法和现象: 。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省遵义市高三上第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.氯气溶于水形成氯水:Cl2+H2O 2H++Cl-+ClO-
2H++Cl-+ClO-
B.将FeO溶解于足量稀HNO3中:FeO+2H+ Fe2++H2O
Fe2++H2O
C.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-
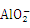 +2H2O
+2H2O
D.SO2用过量NaOH溶液吸收:SO2+2OH-
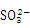 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上8月月考化学试卷(解析版) 题型:选择题
下列解释事实的方程式不正确的是( )
A.Fe2O3溶于氢碘酸溶液中:Fe2O3 + 6H+ === 2Fe3+ + 3H2O
B.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O === 2AlO2-+3H2↑
C.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- +Ca2++OH-=== CaCO3↓+H2O
D.在Cu2O固体中加入足量的稀硫酸:Cu2O + 2H+ === Cu + Cu2+ + H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017年新疆兵团第二师华山中学高二上学前考化学卷(解析版) 题型:推断题
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请用相关的化学术语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA[ | 0 |
2 |
|
|
| ⑤ |
| ⑥ | ⑦ |
|
3 | ① | ③ | ④ |
|
|
| ⑧ | ⑨ |
4 | ② |
|
|
|
|
|
|
|
(1) 在这些元素中,最不活泼的是 ,非金属性最强的是___________,金属性最强的是___________;(填元素符号或化学式,下同。)
(2) 这些元素形成的最高价氧化物对应的水化物中碱性最强的 ,酸性最强的__________;
(3) ①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4) ⑥的氢化物的电子式为 ,① 在空气中燃烧后生成产物的电子式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017年新疆兵团第二师华山中学高二上学前考化学卷(解析版) 题型:选择题
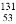 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中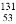 I的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
I的含量变化来监测核电站是否发生放射性物质泄漏。下列有关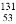 I的叙述中错误的是
I的叙述中错误的是
A. 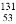 I的化学性质与
I的化学性质与 I相同 B.
I相同 B. 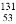 I的原子序数为53
I的原子序数为53
C. 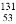 I的原子核外电子数为78 D.
I的原子核外电子数为78 D. 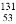 I的原子核内中子数多于质子数
I的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上开学考化学卷(解析版) 题型:实验题
某同学对“菠菜中富含可溶性草酸盐和碳酸盐,与豆腐同食会引起结石”的说法产生了兴趣。
探究一 菠菜里是否含有可溶性草酸盐和碳酸盐?
【查阅资料】
①可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙。
②醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。
【实验流程】
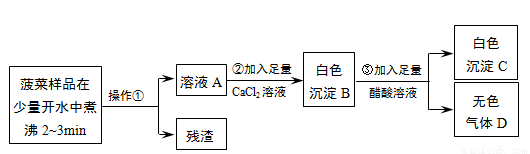
根据流程回答问题:(1)操作①是_________。 ( 2)加入足量CaCl2溶液的目的是_________。
(3)已知气体D能使澄清石灰水变浑浊,步骤③的化学反应方程式为_________。
【实验结论】菠菜里含有可溶性草酸盐和碳酸盐。
探究二 人体结石的主要成分是草酸钙,草酸钙高温分解的产物是什么?
【查阅资料】
① 草酸钙高温完全分解得到两种气态氧化物和一种固态氧化物。
② 12.8 g的草酸钙分解过程中温度与剩余固体的质量关系如下图所示。
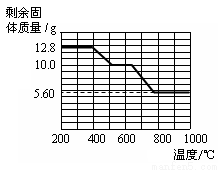
【实验分析】(4)草酸钙高温完全分解的化学方程式为_____________。
(5)通过上图数据分析,700℃时剩余固体的成分是_____________。
(6)请你设计实验,验证700℃时剩余固体的成分。
实验操作 | 实验现象 | 实验结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com