
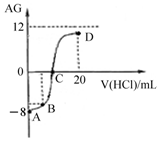
 若用AG表示溶液的酸度,其表达式为:AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$].室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
若用AG表示溶液的酸度,其表达式为:AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$].室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )| A. | 该滴定过程可选择酚酞作为指示剂 | |
| B. | 若B点加入的盐酸溶液体积为5 mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-) | |
| C. | 滴定过程中从A点到D点溶液中水的电离程度:A<B<C<D | |
| D. | C点时加入盐酸溶液的体积等于10 mL |
分析 A.用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,AG=-8,AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$],$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-8,c(H+)c(OH-)=10-14,c(OH-)=10-3mol/L,说明MOH为弱碱,恰好反应溶液显酸性;
B.若B点加入的盐酸溶液体积为5 mL,得到等浓度的MCl和MOH混合溶液,溶液中存在电荷守恒和物料守恒计算判断;
C.滴定过程中从A点到D点溶液中水的电离程度,A-B滴入盐酸溶液中氢氧根离子浓度减小,对水抑制程度减小,到恰好反应MCl,M+离子水解促进水电离,电离程度最大,继续加入盐酸抑制水电离;
D.C点是AG=0,c(H+)=c(OH-)=10-7,溶液呈中性,溶质为MCl和MOH混合溶液.
解答 解:A.用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,AG=-8,AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$],$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-8,c(H+)c(OH-)=10-14,c(OH-)=10-3mol/L,说明MOH为弱碱,恰好反应溶液显酸性,选择甲基橙判断反应终点,故A错误;
B.若B点加入的盐酸溶液体积为5 mL,得到等浓度的MCl和MOH混合溶液,溶液中存在电荷守恒c(M+)+c(H+)=c(OH-)+c(Cl-),物料守恒为:c(M+)+c(MOH)=c(Cl-),消去氯离子得到:c(M+)+2c(H+)=c(MOH)+2c(OH-),故B正确;
C.滴定过程中从A点到D点溶液中水的电离程度,A-B滴入盐酸溶液中氢氧根离子浓度减小,对水抑制程度减小,到恰好反应MCl,M+离子水解促进水电离,电离程度最大,继续加入盐酸抑制水电离,滴定过程中从A点到D点溶液中水的电离程度,D<A<B<C,故C错误;
D.C点是AG=0,c(H+)=c(OH-)=10-7,溶液呈中性,溶质为MCl和MOH混合溶液,C点时加入盐酸溶液的体积小于10 mL,故D错误;
故选B.
点评 本题考查了酸碱反应后溶液溶质成分、溶液酸碱性、离子浓度关系的计算分析判断,掌握基础是解题关键,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:W>X>Z | |
| B. | 最简单气态氢化物的稳定性:W>Z>Y | |
| C. | 最高价氧化物对应水化物的酸性:Z>Y>X | |
| D. | W与Y形成的化合物中只含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;B与E形成的化合物
;B与E形成的化合物 ;A、B、E形成的化合物Na+
;A、B、E形成的化合物Na+ ;D、E形成的化合物
;D、E形成的化合物 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
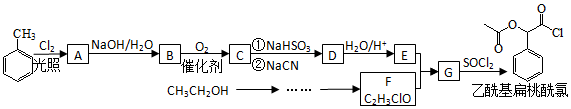
 ;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X为IA族时,Y不可能是第三周期VIA族元素 | |
| B. | 由X、Y、Z、W四种元素不可能形成其原子个数比为1:3:1:1的化合物 | |
| C. | Z元素的原子半径一定小于W元素的原子半径 | |
| D. | 若X为IVA族元素时,X、Y两元素可形成含有共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )可用于制造利胆药.下列有关对羟基苯乙酮的说法错误的是( )
)可用于制造利胆药.下列有关对羟基苯乙酮的说法错误的是( )| A. | 分于式为C8H8O2 | |
| B. | 分子中的碳、氧原子可能都处于同一平面 | |
| C. | 能与氢气发生加成反应 | |
| D. | 含有苯环的羧酸类同分异构体有3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com