
【题目】工厂化验员检验某含有KBrO3、KBr及惰性物的样品。化验员称取了该固体样品1.000 g,加水溶解后配成100 mL溶液X。
Ⅰ. 取25.00 mL溶液X,加入稀硫酸,然后用Na2SO3将BrO![]() 还原为Br-;
还原为Br-;
Ⅱ. 去除过量的SO![]() 后调至中性;
后调至中性;
Ⅲ. 加入K2CrO4作指示剂,用0.100 0 mol·L-1AgNO3标准溶液滴定Br-至终点,消耗 AgNO3标准溶液11.25 mL;
Ⅳ. 另取25.00 mL溶液X,酸化后加热,再用碱液调至中性,测定过剩Br-,消耗上述AgNO3标准溶液3.75 mL。
已知:①25 ℃时,Ag2CrO4(砖红色)的Ksp=1.12×10-12,AgBr(浅黄色)的Ksp=5.0×
10-15;
②Ⅳ中酸化时发生反应:BrO![]() +5Br-+6H+=== 3Br2+3H2O
+5Br-+6H+=== 3Br2+3H2O
请回答:
(1)步骤Ⅰ中,反应的离子方程式为________________________________。
(2)步骤Ⅲ中,滴定终点的现象为_____________________________________________。
(3)步骤Ⅳ中,加热的目的是________________________。
(4)计算试样中KBrO3质量分数。(写出计算过程,结果保留3位有效数字)_______________
【答案】3SO32-+BrO3-===Br-+3SO42- 当滴入最后一滴AgNO3溶液时,产生砖红色沉淀 除去溶解在溶液中的Br2(或使Br2挥发) w(KBrO3)= 8.35% 第一次所取25.00 mL溶液中:n(Br-)总=n(AgBr)=0.100 0 mol·L-1×11.25×10-3 L=1.125×10-3 mol所以,n(BrO![]() )+n(Br-)=n(Br-)总=1.125×10-3 mol (1分)第二次所取25.00 mL溶液,加酸反应后:n(Br-)余=0.100 0mol·L-1× 3.75×10-3L=3.75×10-4 mol 由步骤Ⅳ可知:BrO
)+n(Br-)=n(Br-)总=1.125×10-3 mol (1分)第二次所取25.00 mL溶液,加酸反应后:n(Br-)余=0.100 0mol·L-1× 3.75×10-3L=3.75×10-4 mol 由步骤Ⅳ可知:BrO![]() ~5Br-所以,n(BrO
~5Br-所以,n(BrO![]() )=
)=![]() ×[n(Br-)总-n(Br-)余]=
×[n(Br-)总-n(Br-)余]=![]() ×(1.125×10-3 mol-3.75×10-4 mol)=1.25×10-4 mol由1 g样品配成100 mL溶液,且每次实验取的是25 mL所以,w(KBrO3)=
×(1.125×10-3 mol-3.75×10-4 mol)=1.25×10-4 mol由1 g样品配成100 mL溶液,且每次实验取的是25 mL所以,w(KBrO3)=![]() ×100%=8.35%
×100%=8.35%
【解析】
(1) 步骤Ⅰ中,“加入稀硫酸,然后用Na2SO3将BrO![]() 还原为Br-”,SO32-是还原剂,其氧化产物是SO42-,BrO3-是氧化剂,还原产物是Br-,再根据化合价升降守恒和元素守恒配平其离子方程式。
还原为Br-”,SO32-是还原剂,其氧化产物是SO42-,BrO3-是氧化剂,还原产物是Br-,再根据化合价升降守恒和元素守恒配平其离子方程式。
(2) 步骤Ⅲ中,待测溶液中的Br-与标准溶液反应:Ag++Br-=AgBr↓生成浅黄色沉淀,当Br-耗尽,再多一滴AgNO3标准溶液即发生2Ag++CrO42-=Ag2CrO4↓,产生砖红色沉淀,即表示达到滴定终点。
(3) 步骤Ⅳ中,酸化时使KBrO3与KBr反应:BrO![]() +5Br-+6H+=== 3Br2+3H2O,再测定剩余的Br-,而溶液中溶解的Br2会干扰Br-的测定,通过加热让Br2挥发而除去。
+5Br-+6H+=== 3Br2+3H2O,再测定剩余的Br-,而溶液中溶解的Br2会干扰Br-的测定,通过加热让Br2挥发而除去。
(4)由步骤III消耗AgNO3标准溶液11.25mL可计算25.00mL溶液X中KBrO3和KBr中溴元素总物质的量;由反应式BrO![]() +5Br-+6H+=== 3Br2+3H2O可知,其中BrO3-与参加反应的Br-的物质的量之比为1:5,再由步骤IV的数据计算25.00mL溶液X中KBrO3的物质的量。
+5Br-+6H+=== 3Br2+3H2O可知,其中BrO3-与参加反应的Br-的物质的量之比为1:5,再由步骤IV的数据计算25.00mL溶液X中KBrO3的物质的量。
(1) 步骤Ⅰ中,“加入稀硫酸,然后用Na2SO3将BrO![]() 还原为Br-”,SO32-是还原剂,其氧化产物是SO42-,BrO3-是氧化剂,还原产物是Br-,根据化合价升降守恒和元素守恒配平,其反应的离子方程式为:3SO32-+BrO3-===Br-+3SO42-。
还原为Br-”,SO32-是还原剂,其氧化产物是SO42-,BrO3-是氧化剂,还原产物是Br-,根据化合价升降守恒和元素守恒配平,其反应的离子方程式为:3SO32-+BrO3-===Br-+3SO42-。
(2)步骤Ⅲ中,待测溶液中的Br-与标准溶液反应:Ag++Br-=AgBr↓,生成浅黄色沉淀,当Br-耗尽,再多一滴AgNO3标准溶液即发生2Ag++CrO42-=Ag2CrO4↓,产生砖红色沉淀,即表示达到滴定终点。滴定终点的现象为:当滴入最后一滴AgNO3溶液时,产生砖红色沉淀。
(3) 步骤Ⅳ中,酸化时使KBrO3与KBr反应:BrO![]() +5Br-+6H+=== 3Br2+3H2O,再测定剩余的Br-,而溶液中溶解的Br2会干扰Br-的测定,通过加热让Br2挥发而除去。所以加热的目的是除去溶解在溶液中的Br2(或使Br2挥发)。
+5Br-+6H+=== 3Br2+3H2O,再测定剩余的Br-,而溶液中溶解的Br2会干扰Br-的测定,通过加热让Br2挥发而除去。所以加热的目的是除去溶解在溶液中的Br2(或使Br2挥发)。
(4)根据反应方程式Ag++Br-=AgBr↓,25.00mL溶液X中KBrO3和KBr中的溴元素总物质的量=n(Br-)总=n(AgNO3)=0.100 0 mol·L-1×11.25×10-3 L=1.125×10-3 mol,即n(BrO![]() )+n(Br-)=n(Br-)总=1.125×10-3 mol。由步骤IV可知,第二次取25.00mL样品溶液加酸反应完全后剩余Br-的物质的量n(Br-)余=0.100 0mol·L-1× 3.75×10-3L=3.75×10-4 mol。由反应方程式BrO
)+n(Br-)=n(Br-)总=1.125×10-3 mol。由步骤IV可知,第二次取25.00mL样品溶液加酸反应完全后剩余Br-的物质的量n(Br-)余=0.100 0mol·L-1× 3.75×10-3L=3.75×10-4 mol。由反应方程式BrO![]() +5Br-+6H+=== 3Br2+3H2O可知,其中BrO3-与参加反应的Br-的物质的量之比为1:5,所以25.00mL溶液X中含BrO3-的物质的量n(BrO
+5Br-+6H+=== 3Br2+3H2O可知,其中BrO3-与参加反应的Br-的物质的量之比为1:5,所以25.00mL溶液X中含BrO3-的物质的量n(BrO![]() )=
)=![]() ×[n(Br-)总-n(Br-)余]=
×[n(Br-)总-n(Br-)余]=![]() ×(1.125×10-3 mol-3.75×10-4 mol)=1.25×10-4 mol。由1 g样品配成100 mL溶液,且每次实验取的是25 mL,所以试样中KBrO3的质量分数w(KBrO3)=
×(1.125×10-3 mol-3.75×10-4 mol)=1.25×10-4 mol。由1 g样品配成100 mL溶液,且每次实验取的是25 mL,所以试样中KBrO3的质量分数w(KBrO3)=![]() ×100%=8.35%。
×100%=8.35%。


科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
A. v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期主族元素,且原子序数依次增大,X与W同主族,Z与R同主族,X的原子半径比Y的小,Y的最高价氧化物对应的水化物是强酸,Z的最外层电子数是其内层电子数的3倍。下列说法正确的是
A. 原子半径:r(W)>r(Z)>r(Y)
B. 简单气态氢化物的热稳定性:Y>Z
C. R的氧化物对应的水化物均为强酸
D. W2Z2与X2R均含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.050 0 mol·L-1H2C2O4溶液所得滴定曲线如图所示。下列关于溶液中微粒的物质的量浓度关系一定正确的是

A. 在整个滴定过程中,始终存在:c(H+)+ c(Na+) =c(OH-)+c(C2O42-)+ c(HC2O4-)
B. 当V[NaOH(aq)]=10.00 mL时:c(Na+)> c(HC2O4-)>c(C2O42-)> c(H2C2O4)
C. 当V[NaOH(aq)]=15.00 mL时:3c(Na+)= 2c(C2O42-)+ 2c(HC2O4-)+2c(H2C2O4)
D. 当 V[NaOH(aq)]=30.00 mL时:c(C2O42-)+2c(HC2O4-)+3c(H2C2O4)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。
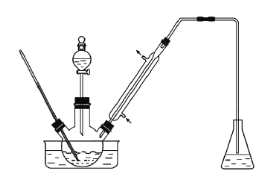
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1) 实验装置中冷凝管的主要作用是___________________。
(2) 步骤1所加入的物质中,有一种物质是催化剂,其化学式为__________________
(3) 写出由苯甲醛制取间溴苯甲醛的化学方程式_____________________________________________________
(4) 为防止污染环境,锥形瓶中盛装的溶液应该是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚(CH3OCH3)被称为21世纪的新型燃料,工业上以CO和H2为原料生产二甲醚。已知:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ/mol
CH3OH(g) △H=-99kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-24 kJ/mol
CH3OCH3(g)+H2O(g) △H=-24 kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41 kJ/mol
H2(g)+CO2(g) △H=-41 kJ/mol
(1)反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)的△H=___________。
CH3OCH3(g)+H2O(g)的△H=___________。
(2)某温度下,将4.0molH2和4.0molCO充入容积为1L的密闭容器中,发生反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),5min时CO2的物质的量浓度为0.5mo1/L,10min后反应达到平衡状态,测得二甲醚的体积分数为25%。
CH3OCH3(g)+CO2(g),5min时CO2的物质的量浓度为0.5mo1/L,10min后反应达到平衡状态,测得二甲醚的体积分数为25%。
①5min时CO的转化率=___________;
②该温度下此反应的平衡常数K=___________;
③下列措施能提高 CH3OCH3平衡产率的有___________(填标号)。
A.分离出 CH3OCH3 B.升高温度 C.增大压强 D.改用高效催化剂
Ⅱ.液氨是一种良好的储氢物质
已知:2NH3(g)![]() N2(g)+3H2(g) △H=+92.4 kJ/mol
N2(g)+3H2(g) △H=+92.4 kJ/mol
其他条件相同时,反应在不同金属催化剂作用下进行相同时间后,氨的转化率[a(NH3)]随反应温度的变化情况如图所示。

(1)用___________作催化剂时,氨气分解反应的活化能最大。
(2)a点所代表的状态___________(填“是”或“不是”)平衡状态。
(3)c点时NH3的转化率高于b点时NH3的转化率,原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+ (aq) + Cu(s) == Cu2+ (aq) + 2Ag (s)设计的原电池如下图。

请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是_____________;
(2)银电极为电池的_________极;银电极上发生的电极反应式______________。
(3)外电路中的电子是从________电极流向______电极(填电极的材料)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)已知:2NO2(g)= N2O4(g) △H=-55.3kJ/mol
N2O5(g)=2NO2(g)+![]() O2(g) △H=+53.1 kJ/mol
O2(g) △H=+53.1 kJ/mol
则:N2O5(g)=N2O4(g)+![]() O2(g) △H=___________ kJ/mol
O2(g) △H=___________ kJ/mol
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1。若反应中n(NO)︰n(O2)=2︰1,则总反应的化学方程式为___________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是___________。

(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:

①从0~2s内该反应的平均速率υ(NO)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________ L/mol。 (结果保留3位有效数字)。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T2___________T1(填“>”、“<”或“=")。
④已知2NO(g)+O2(g)![]() 2NO2的反应历程为:
2NO2的反应历程为:
第一步NO+NO![]() N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
下列叙述正确的是___________(填标号)。
A. υ(第一步的正反应)< υ(第二步的反应) B.总反应快慢由第二步决定
C.第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙酸、葡萄糖都可用通式Cn(H2O)m表示其组成,所以乙酸也属于糖类
B.凡是能溶于水且具有甜味的化合物都属于糖类
C.蔗糖能发生银镜反应
D.葡萄糖分子中含有醛基,它具有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com