
物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能实现的是( )。
选项转化关系
A
B
C
D
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期期末考试理综化学试卷(解析版) 题型:填空题
工业上生产硫酸的流程图如下:

请回答下列问题:
(1)早期生产硫酸以黄铁矿为原料,但现在工厂生产硫酸以硫黄为原料,理由是 。
(2)在气体进入催化反应室前需净化的原因是 。
(3)在催化反应室中通常使用常压,在此条件下SO2的转化率为90%。但是部分发达国家采取高压条件下制取SO3,采取加压措施的目的除了加快反应速率外,还可以 ,从而提高生产效率 。
(4)工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染,废物利用的目的。用化学方程式表示其反应原理: 。
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:填空题
能源的开发利用与人类社会的可持续发展息息相关。
Ⅰ.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________ kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:____________________________________________________________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中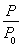 与时间t的关系如图所示。
与时间t的关系如图所示。

请回答下列问题:
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为________。
③欲提高N2的转化率,可采取的措施有________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25 ℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
下列各组离子在指定的溶液中能大量共存的是( )。
A.pH=14的溶液中:Na+、Al3+、Cl-、NO3-
B.滴入KSCN溶液显血红色的溶液中:K+、Fe2+、SO42-、Cl-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、K+、HCO3-、NO3-
D.c(I-)=0.1 mol·L-1的溶液中:Na+、Fe3+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:选择题
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是( )。

A.X为SO2气体,也可将SO2换成Na2SO3
B.设备Y为蒸馏塔
C.在提取溴的过程中一定有Br-被氧化
D.工业上每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况下)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第8讲电化学练习卷(解析版) 题型:填空题
甲、乙的实验装置如图所示,丙、丁分别是氯碱工业生产示意图和制备金属钛的示意图。

请回答下列问题:
(1)写出甲装置中碳棒表面的电极反应式:_______________________________。
(2)已知:5Cl2+I2+6H2O=10HCl+2HIO3。若将湿润的淀粉?KI试纸置于乙装置中的碳棒附近,现象为________________________________;若乙装置中转移0.02 mol电子后停止实验,烧杯中溶液的体积为200 mL,则此时溶液的pH=________。(室温条件下,且不考虑电解产物的相互反应)
(3)工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙装置中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置,Na+的移动方向如图中标注,则H2的出口是________(填“C”、“D”、“E”或“F”);________(填“能”或“不能”)将阳离子交换膜换成阴离子交换膜。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaO作电解质,利用丁装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极的电极反应式:___________________________________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)__________________________________________________________。
③电解过程中需定期更换阳极材料的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第8讲电化学练习卷(解析版) 题型:选择题
如图所示,?为直流电源,?为浸透饱和氯化钠溶液和酚酞试液的滤纸,?为电镀槽。接通电路(未闭合K)后发现?上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )。

A.b为直流电源的负极
B.f极为阴极,发生还原反应
C.e极材料为铁片,f极材料为铜片
D.可选用CuSO4溶液或CuCl2溶液作电镀液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)??B(g)+C(g) ΔH=+85.1 kJ·mol-1
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:选择题
LiAlH4是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH4在125 ℃分解为LiH、H2和Al。下列叙述错误的是( )。
A.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
B.LiAlH4与D2O反应,所得氢气的摩尔质量为4 g·mol-1
C.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子
D.LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O=Al(OH)3+LiOH+4H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com