
【题目】甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料. 已知:
①2H2(g)+O2(g)═2H2O(l)△H1=﹣571.6kJmol﹣1
②CH4(g)+ ![]() O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1
O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJmol﹣1
(1)氢气的燃烧热为 , 写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是 . 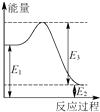
A.E1=36kJ B.E2=36kJ C.E1﹣E2=36kJ D.E3﹣E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能 | 348 | 413 | 436 | 358 | 1072 | 463 |
则△H1= .
【答案】
(1)△H=﹣285.8kJ?mol﹣1;CH4(g)+ ![]() O2(g)═CO(g)+2H2O(l)△H=﹣607.6kJ?mol﹣1
O2(g)═CO(g)+2H2O(l)△H=﹣607.6kJ?mol﹣1
(2)0.75;C
(3)﹣116kJ?mol﹣1
【解析】解:(1)2H2(g)+O2(g)═2H2O(l)△H1=﹣571.6kJmol﹣1 , 即1mol氢气完全燃烧生成液态水放出的热量285.8 kJ,故氢气的燃烧热为△H=﹣285.8 kJmol﹣1 , ①2H2(g)+O2(g)═2H2O(l)△H1=﹣571.6kJmol﹣1②CH4(g)+ ![]() O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1依据盖斯定律①+②得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH4(g)+
O2(g)═CO(g)+2H2(g)△H2=﹣36kJmol﹣1依据盖斯定律①+②得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH4(g)+ ![]() O2(g)═CO(g)+2H2O(l)△H=﹣607.6 kJmol﹣1 , 所以答案是:△H=﹣285.8 kJmol﹣1;CH4(g)+
O2(g)═CO(g)+2H2O(l)△H=﹣607.6 kJmol﹣1 , 所以答案是:△H=﹣285.8 kJmol﹣1;CH4(g)+ ![]() O2(g)═CO(g)+2H2O(l)△H=﹣607.6 kJmol﹣1;(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差,所以答案是:0.75;C;(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能﹣生成物总键能,依据图表提供的化学键的键能计算得到△H1=1072kJmol﹣1+2×436kJmol﹣1﹣(3×413kJmol﹣1+358kJmol﹣1+463kJmol﹣1)=﹣116 kJmol﹣1 , 所以答案是:﹣116 kJmol﹣1 .
O2(g)═CO(g)+2H2O(l)△H=﹣607.6 kJmol﹣1;(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差,所以答案是:0.75;C;(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能﹣生成物总键能,依据图表提供的化学键的键能计算得到△H1=1072kJmol﹣1+2×436kJmol﹣1﹣(3×413kJmol﹣1+358kJmol﹣1+463kJmol﹣1)=﹣116 kJmol﹣1 , 所以答案是:﹣116 kJmol﹣1 .


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.生产K2FeO4的工艺流程如图所示: 
(1)写出“氧化”过程中生成Na2FeO4的化学方程式: .
(2)“转化”过程中发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1mol N2与4mol H2反应生成的NH3分子数为2NA
C.1mol Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,A元素形成的﹣2价阴离子比氦的核外电子数多8个.B元素的一种氧化物为淡黄色固体,该固体遇到CO2能生成A的单质.C为原子核内有12个中子的二价金属,当2.4g C与足量盐酸反应时,生成标准状况下的H2 2.24L.D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子.回答下列问题.
(1)C离子的结构示意图
(2)A、E氢化物的稳定性比较(填化学式)
(3)A,B,C,D四种离子半径由大到小顺序(用离子符号表示).
(4)用电子式表示C与D形成化合物的形成过程: .
(5)写出D单质与B的最高价氧化物对应水化物反应的离子方程式: .
(6)写出Cu与E的最高价氧化物对应水化物稀溶液反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W,X,Y,Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01molL﹣1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( ) 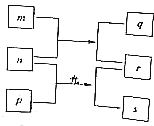
A.原子半径的大小W<X<Y
B.元素的非金属性Z>X>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是 .
(2)CrO42﹣和Cr2O72﹣在溶液中可相互转化.室温下,初始浓度为1.0molL﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示.
①用离子方程式表示Na2CrO4溶液中的转化反应 .
②由图可知,溶液酸性增大,CrO42﹣的平衡转化率(填“增大“减小”或“不变”).根据A点数据,计算出该转化反应的平衡常数为 .
③升高温度,溶液中CrO42﹣的平衡转化率减小,则该反应的△H(填“大于”“小于”或“等于”).
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl﹣ , 利用Ag+与CrO42﹣生成砖红色沉淀,指示到达滴定终点.当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5molL﹣1)时,溶液中c(Ag+)为molL﹣1 , 此时溶液中c(CrO42﹣)等于molL﹣1 . (已知Ag2 CrO4、AgCl的Ksp分别为2.0×10﹣12和2.0×10﹣10).
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+ , 反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题: 
(1)图中A点表示的意义是;
(2)图中B点表示的意义是;
(3)假如溶液中生成了沉淀0.39g,则此时用去NaOH溶液的体积最少是 . (写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图方框中的每一字母各代表一种物质或溶液,它们在一定条件下发生反应的关系如图1(图中略去了一些物质).已知A、D是两种常见的金属,B是红棕色金属氧化物,C是一种熔点很高的金属氧化物.
根据示意图回答下列问题:
(1)写出下列物质的化学式:B , K;
(2)写出H→G的离子方程式;
(3)写出N→M化学方程式;
(4)实验室在配制H的溶液时,往往要加入少量的D,其作用是 .
(5)检验G中的阳离子的常用方法和现象是 .
(6)取图1中一定量F溶液,向其中逐滴加入NaOH溶液直至过量.如图2所示示意图能表示实验过程中沉淀的质量随NaOH溶液体积变化的是(填序号) . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们饮用的水是由源水净化所得。已知,明矾能将水中的悬浮物凝聚而沉淀,氯气可杀菌。家庭饮用水的净化过程正确的是 ( )。
A.源水→过滤→加氯气→加明矾→沉淀→净水
B.源水→加氯气→过滤→加明矾→沉淀→净水
C.源水→加明矾→加氯气→过滤→沉淀→净水
D.源水→加明矾→沉淀→过滤→加氯气→净水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com