
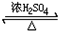 CH3COOC2H5+H2O,属于酯化(取代)反应.
CH3COOC2H5+H2O,属于酯化(取代)反应. )是一种重要的化工原料.将苯乙烯通入到溴水中,反应的化学方程式为:C6H5-CH=CH2+Br2→C6H5-CHBr-CH2Br.
)是一种重要的化工原料.将苯乙烯通入到溴水中,反应的化学方程式为:C6H5-CH=CH2+Br2→C6H5-CHBr-CH2Br. .
. 分析 (1)乙醇为含有碳、氢、氧三种元素的物质,燃烧生成二氧化碳和水,物质与氧发生的反应属于氧化反应;
(2)乙酸与乙醇在浓硫酸作用下发生酯化反应,本质为酸脱羟基,醇脱氢,属于取代反应;
(3)苯乙烯中含有碳碳双键,在一定条件下能够与与溴的四氯化碳溶液反应发生加成反应;
(4)丙烯含碳碳双键,发生加聚反应生成聚丙烯.
解答 解:(1)乙醇燃烧生成二氧化碳和水,反应的化学方程式为:C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O,该反应为乙醇与氧气的反应,属于氧化反应,
故答案为:C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O;氧化;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应(取代反应)生成乙酸乙酯和水,该反应为可逆反应,CH3COOH+C2H5OH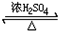 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH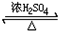 CH3COOC2H5+H2O;酯化(取代);
CH3COOC2H5+H2O;酯化(取代);
(3)苯乙烯含有碳碳双键,与溴发生加成反应,化学方程式为:C6H5-CH=CH2+Br2→C6H5-CHBr-CH2Br,
故答案为:C6H5-CH=CH2+Br2→C6H5-CHBr-CH2Br;
(4)丙烯能发生加聚反应得到聚丙烯,方程式为 ,
,
故答案为: .
.
点评 本题考查了化学方程式的书写及有机物的性质,题目难度不大,注意化学方程式的书写方法,本题侧重对学生基础知识的训练和检验,提高学生灵活运用基础知识能力,注意有机物官能团的性质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
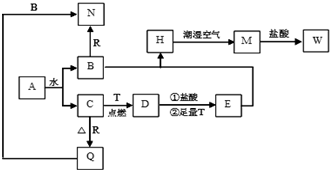
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、Cl- | B. | H+、Ag+、Cl- | C. | Na+、H+、NO3- | D. | Fe2+、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
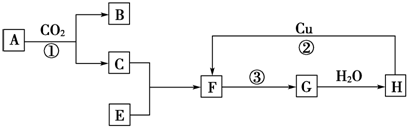
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 现象 | 化学反应方程式 | |
| ① | 试管中有白色沉淀生成 | Ba(NO3)2+CuSO4═BaSO4↓+Cu(NO3)2 |
| ② | 试管中有蓝色沉淀生成 | CuSO4+2NaOH═Cu(OH2)↓+2NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:Z<Y<X<W | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | X元素最高价氧化物对应水化物的化学式为:HXO3 | |
| D. | 四种元素的气态氢化物中,W的气态氢化物最稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
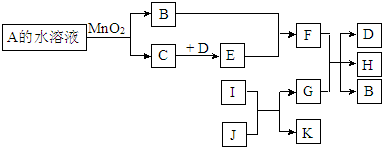
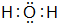 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com