
【题目】过氧化氢的水溶液俗称双氧水,它的用途很广,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)过氧化氢含有的化学键为______________。
(2)Na2O2、K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢溶液可取上述某种过氧化物与适量稀硫酸作用,然后经________操作即可制得,则上述最适合的过氧化物是__________。
(3)几乎所有古代艺术家的油画都是以铅白2PbCO3·Pb(OH)2为底色,但若空气中含H2S气体,铅白就会变黑,可以用H2O2将黑色物质氧化成颜色相近的PbSO4而修复,写出铅白在空气中变黑的化学方程式:____________________________________________。
(4)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%~70%的过氧化氢溶液中,则该反应的化学方程式为______________,过氧化氢比理论用量稍多,其目的是______________。反应温度最好控制在30~70 ℃,温度不宜过高,其主要原因是_________________。
(5)过氧化氢与碳酸钠的加合物 Na2CO3·xH2O2比较稳定,方便储存,可用于消毒、漂白,现称取100 g Na2CO3·xH2O2晶体加热,实验结果如图所示,则该晶体的组成为______________________。

【答案】 极性键、非极性键 过滤 BaO2 2PbCO3·Pb(OH)2+3H2S===3PbS+2CO2+4H2O Ca(OH)2+2HCHO+2H2O2===Ca(HCOO)2+4H2O 使甲醛充分氧化,提高甲醛的利用率和产品纯度 防止H2O2分解和甲醛挥发 Na2CO3·1.5H2O2
【解析】(1)过氧化氢属于共价化合物,其中含有的化学键有极性键、非极性键,故答案为:极性键、非极性键;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2;故答案为:过滤;BaO2;
(3)铅白2PbCO3Pb(OH)2与H2S气体反应生成黑色的硫化铅,反应的化学方程式为2PbCO3Pb(OH)2+3H2S=3PbS+2CO2+4H2O,故答案为:2PbCO3Pb(OH)2+3H2S=3PbS+2CO2+4H2O;
(4)实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中,Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑,化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率,则加过量的过氧化氢能使甲醛充分氧化,提高甲醛的利用率和产品纯度;温度较高时,双氧水易分解,甲醛易挥发,则反应温度最好控制在30-70℃之间,温度不易过高,能防止H2O2分解和甲醛挥发;故答案为:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑;使甲醛充分氧化,提高甲醛的利用率和产品纯度;防止H2O2分解和甲醛挥发;
(5)2Na2CO3xH2O2![]() 2Na2CO3+xO2↑+2xH2O,根据温度和残留固体的相对质量分数示意图,当温度为148℃时,所的固体只有碳酸钠,质量分数为67.6%,所以固体质量减少的百分数为
2Na2CO3+xO2↑+2xH2O,根据温度和残留固体的相对质量分数示意图,当温度为148℃时,所的固体只有碳酸钠,质量分数为67.6%,所以固体质量减少的百分数为![]() ×100%=1-67.6%,解得x=1.5,化学式为:Na2CO31.5H2O2,故答案为:Na2CO31.5H2O2。
×100%=1-67.6%,解得x=1.5,化学式为:Na2CO31.5H2O2,故答案为:Na2CO31.5H2O2。


科目:高中化学 来源: 题型:
【题目】乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,下列说法不正确的是( )

A. a极为电池的负极
B. 电池工作时,1mol乙醇被氧化时就有6mol电子转移
C. 电池正极的电极反应为:4H+ + O2 + 4e-=2H2O
D. 电池工作时电流由b极沿导线经灯泡再到a极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向H2O2溶液中加入适量稀硫酸酸化的硫酸亚铁溶液,依次观察到如下现象:①反应刚开始,仅有少量气泡产生;②反应片刻后,有大量气泡产生;③试管底部最终出现红褐色沉淀。下列判断正确的是
A.①中仅发生一个反应 B.Fe3+能催化H2O2的分解
C.反应过程中溶液pH不断减小 D.FeSO4与等物质的量的H2O2恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 氢是原子半径最小的元素 B. 稀有气体元素原子的最外层电子数均为8
C. 周期表中有7个主族、7个副族 D. 硫元素位于第三周期VIA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是一种绿色氧化剂、还原剂,工业上有多种方法制备H2O2。
(1)①研究表明,H2O2相当于二元弱酸,则它的一级电离方程式为_______________,已知常温下1 L的H2O2相当于48.3 mol,其K1≈1.67×10-12。则该温度下H2O2中c(H+)约为__________,写出它与足量Ba(OH)2反应的化学方程式:_____________。
②乙基蒽醌法是制备过氧化氢最常用的方法,其主要过程可以用下图表示,写出此过程的总化学方程式:___________________________________________。

③空气阴极法制备H2O2是一种环境友好型、节能型制备方法,电解总方程式为3H2O+3O2![]() 3H2O2+O3,则阳极上电极反应式为________________________。
3H2O2+O3,则阳极上电极反应式为________________________。
(2)氧也能与钾元素形成K2O、K2O2、KO2、KO3等氧化物,其中KO2是一种比Na2O2效率高的供氧剂,写出它与CO2反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年11月,“神舟八号”在酒泉发射升空,并取得圆满成功。“神舟八号”的运载火箭所用燃料是偏二甲肼(C2H8N2)(其中N的化合价为-3)和四氧化二氮(N2O4)。在火箭升空过程 中,燃料发生反应: C2H8N2+ 2N2O4=2CO2+3N2+4H2O提供能量。下列有关叙述正确的是( )
A.该燃料绿色环保,在燃烧过程中不会造成任何环境污染
B.该反应中N2O4是氧化剂,偏二甲肼是还原剂
C.N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物
D.每有0.6 mol N2生成,转移电子数目为2.4![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2,
②KClO3+6HCl=3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6∶1
D. ③中1 mol还原剂反应则氧化剂得到电子的物质的量为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000 mL,供选择的电极材料有纯铜片和纯锌片。请回答下列问题:
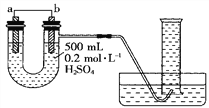
(1)b电极材料为__________,其电极反应式为_________________________。
(2)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为__________,此时a电极质量减少__________g。
II.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有:_____________________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是_________________________________________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有_____________________(答两种);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com