
【题目】下列实验操作正确的是
A. 分液时,先将上层液体从上口倒出
B. 萃取时,振荡后,须打开活塞放气
C. 蒸馏时,先点燃酒精灯,后通冷凝水
D. 蒸发时,将溶剂蒸干一段时间后,熄灭酒精灯
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知:X(g)+3Y(g)![]() 2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
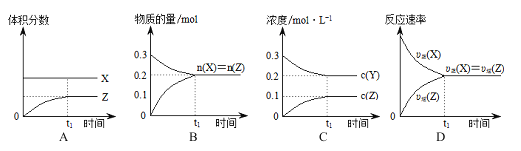
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等体积、等pH的硫酸、盐酸和醋酸三种溶液中,分别滴加等浓度的NaOH溶液,至恰好完全反应,用去NaOH溶液的体积分别为V1、V2、V3,则三者的大小关系正确的是
A. V1<V2<V3 B. V1>V2=V3 C. V1=V2>V3 D. V1=V2<V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算题(要写计算过程)
已知反应:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,现有7.4gCa(OH)2与足量的NH4Cl充分反应。求
CaCl2+2NH3↑+2H2O,现有7.4gCa(OH)2与足量的NH4Cl充分反应。求
(1)生成的NH3在标准状况时的体积为多少?
(2)将所得NH3气体溶于100g水中,若所得氨水的密度为0.8g/mL,则该氨水的物质的量浓度为多少?(结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 高压钠灯常用于道路的照明 B. 饱和石灰水用来制漂白粉
C. 硅晶体用作半导体材料 D. 金属镁常用来制造信号弹和焰火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是

A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并能防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是电解池,锌电极为正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
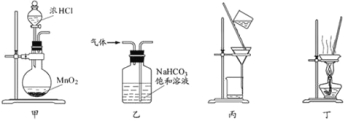
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干NaHCO3溶液制NaHCO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m (n>2,m≤10)的实验流程如下:

已知:盐基度=![]() ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是___________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2][Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c molL-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为a,则该试样的盐基度的计算表达式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶质的质量分数为10%的KOH溶液加热蒸发掉100g水后,得到溶质的质量分数为35%的溶液50mL,此时溶液的物质的量浓度为( )
A.5mol·L-1 B.3.25mol·L-1 C.7mol·L-1 D.6.25mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com