
(8分)(1) 某实验室要用90mL1.00 mol·L-1的NaOH溶液。在配制该NaOH溶液的过程中:
①除了要使用托盘天平、药匙、烧杯、玻璃棒、胶头滴管,还要使用的仪器有 。
②需用托盘天平称取NaOH的质量为 g。
(2)从海带中提取碘的流程如下图:
①指出提取碘的过程中实验操作、操作的名称:a__________、c__________
②在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
。(注:下图试管中深色区为紫红色溶液)
(1)①100mL容量瓶;② 4.0g;(2)①过滤,萃取分液;② D。
解析试题分析:(1)①实验室要用90mL 1.00mol?L-1的NaOH溶液,需要配制100ml1.00mol?L-1的NaOH溶液;配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,根据步骤确定仪器,需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、胶头滴管和100mL容量瓶;②实验室要用90mL 1.00mol?L-1的NaOH溶液,需要配制100ml1.00mol?L-1的NaOH溶液,需用托盘天平称取NaOH的质量=0.100L×1.00mol?L-1×40g/mol=4.0g;(2)①根据题给流程图知,操作a为分离固体和液体混合物的操作,为过滤,操作c为利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取分液;②碘在四氯化碳中的溶解度大于在水中的溶解度,能将碘水中的碘转移到四氯化碳中,四氯化碳的密度比水大,溶解碘后溶液为紫红色,所以在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是溶液分层,上层颜色接近无色,下层呈紫红色;选D。
考点:考查一定物质的量浓度溶液的配制、物质的分离和提纯。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
(1)写出上述实验过程中所用试剂(写化学式):
试剂①_______________________;试剂③________________________。
(2)判断试剂①已过量的方法是:________________________________________。
(3)用化学方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉 (填“能”或“不能”)透过半透膜;
SO42- (填“能”或“不能”)透过半透膜;
请用实验证明上述结果,完成下表(可不填满,也可增加):
限选试剂:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、
碘水、稀盐酸、稀硝酸
| 编号 | 实验操作 | 预期现象和结论 |
| ① | | |
| ② | | |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是 ;所含阴离子相同的两种盐的化学式是 。
(2)D的化学式为 ,D溶液显碱性的原因是(用离子方程式表示) 。
(3)E和氨水反应的离子方程式是 。
(4)设计实验检验B中所含的阳离子:
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(4分)除杂(括号内为杂质)
| 序号 | 物质 | 除杂试剂 |
| (1) | CO2(HCl) | |
| (2) | Fe2O3(Al2O3) | |
| (3) | NaCl溶液(MgCl2) | |
| (4) | NO气体(NO2) | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(9分)海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下: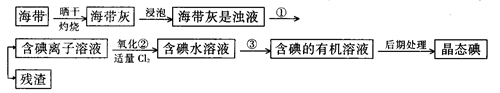
(1)指出提取碘的过程中有关的实验操作名称:
① ;③______________________。
写出实验②中有关反应的离子方程式 _______________________ 。
(2)提取碘的过程中,可供选择的有关试剂是___________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品, ,搅拌。
② 。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3, ,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)某学生为测定某烧碱样品中NaOH的质量分数,进行如下实验(已知该样品中含有少量Na2CO3杂质)
a.在250mL的容量瓶中定容,配制成250mL烧碱溶液。
b.用碱式滴定管量取25.00mL烧碱溶液于锥形瓶中,加入足量BaCl2溶液使Na2CO3完全转变成BaCO3后滴入几滴酚酞指示剂;
c.在天平上准确称取烧碱样品10.5g,在烧杯中用蒸馏水溶解;
d.将物质的量浓度为1.000mol/L的标准硫酸溶液装入酸式滴定管中,调节液面,记下开始时的读数然后开始滴定。
e.在锥形瓶下垫一张白纸,滴定至溶液恰好变为无色为止,记下读数。试填空:
(1)正确操作步骤的顺序是(用字母填空)_____→_____→_____→_____→_______.
(2)酸式(碱式)滴定管在使用前需进行的第一步操作是____________,中学化学实验常用仪器中使用前和滴定管使用有相同操作的不同类玻璃仪器还有 、_______。
(3)重复上述滴定操作,记录数据如下:
| 实验编号 | 标准溶液(H2SO4)(aq) 浓度(mol/L) | 滴定完成时耗酸 体积V(mL) | 待测溶液(NaOH)(aq) 体积V(mL) |
| 1 | 1.000 | 11.00 | 25.00 |
| 2 | 1.000 | 12.04 | 25.00 |
| 3 | 1.000 | 12.18 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
| A.除去SO2气体 | B.除去空气中的水蒸气 | C.有利于气体混合 |
| D.有利于观察空气流速 E.除去反应后多余的氧气 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
对叔丁基苯酚 可用于生产油溶性酚醛树脂等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
可用于生产油溶性酚醛树脂等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
步骤1:按图16组装仪器,在X中加入2.2 mL叔丁基氯(过量)和1.41 g苯酚,搅拌使苯酚完全溶解。
步骤2:向X中加入无水AlCl3固体作催化剂,不断搅拌,有气体放出。
步骤3:反应缓和后,向X中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器X的名称为 。
(2)步骤2中发生主要反应的化学方程式为 。若该反应过于激烈,可采取的一种措施为 。
(3)图16中倒扣漏斗的作用是 。
(4)实验结束后,对产品进行光谱鉴定结果如下。其中属于红外光谱的谱图是 (填字母)。
(5)本实验中,对叔丁基苯酚的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com