
下列说法正确的是
A. 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
B. 在25℃、101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ/mol
C. 在25℃、101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:2016-2017学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+ N(g)  E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol•L-1.下列说法正确的是( )
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol•L-1.下列说法正确的是( )
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8mol•L-1•min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol•L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二下期初摸底化学卷(解析版) 题型:填空题
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用。
(1)液氨储氢是目前研究的重要课题。液氨的电离和水的电离相似,液氨中的氨也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为 。
NH4++NH2-,其离子积常数为1.0×10-30。现将2.3克金属钠投入1.0 L 液氨中,待反应结束后,假设溶液体积不变,所得溶液中NH4+离子浓度为 。
(2)用Pt电极对液氨进行电解可产生H2和N2,则阴极的电极反应式是 。
(3)用NH3催化还原NXOy可以消除氮氧化合物的污染。请写出氨气催化还原NO的化学方程式 。
(4)将一定量的N2和H2充入1L的密闭容器中,在500℃、2×107Pa下反应并达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol,则H2的平衡转化率为 ;在该温度下的平衡常数K= 。
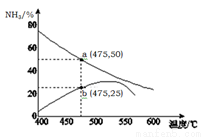
(5 )右图是某压强下,N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。则图中b点,v(正) v(逆)。(填“>”、
)右图是某压强下,N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。则图中b点,v(正) v(逆)。(填“>”、 “=”或“<”)
“=”或“<”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上8月考试化学卷(解析版) 题型:填空题
(1)下图是某煤化工产业链的一部分,已知该产业链中某反应的平衡常数表达式为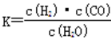 ,已知此反应中生成1g氢气需吸热65.75kJ,它所对应的热化学方程式是 。
,已知此反应中生成1g氢气需吸热65.75kJ,它所对应的热化学方程式是 。

(2)向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明容器内反应达到平衡状态的是 。
A.混合气体的平均相对分子质量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
(3)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0中的所有物质都为气态,起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0中的所有物质都为气态,起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应II绝热恒容 | 0min | 0 | 0 | 2 | 2 |
到平衡时,反应I、II对比,平衡时CH3OH的浓度c(I) c(II)(填“>”“<”或“=”)
反应I,前10min内的平均反应速率v(CH3OH)= 。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡 移动。(填“正向”“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上8月考试化学卷(解析版) 题型:选择题
2.0mol的PCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)  PCl5(g)。达平衡时,PCl5为0.40mol;如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量为
PCl5(g)。达平衡时,PCl5为0.40mol;如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量为
A. 0.40mol B. 0.20mol C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高一上第一次月考化学试卷(解析版) 题型:填空题
20 g A物质和14 g B物质恰好完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学考试化学试卷(解析版) 题型:选择题
某有机物的结构为右图所示,这种有机物不可能具有的性质是
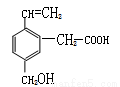
①可以燃烧; ②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应; ⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高二上第一次双周练化学卷(解析版) 题型:实验题
己知:KI溶液在酸性条件下能被空气中的O2氧化。
(1)写出发生反应的离子方程式_______________________。
(2)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成下表中①和②的内容。
(限选试剂:0.1 L mol/L硫酸、0.2 mol/L硫酸、1 mol/L KOH溶液、淀粉溶液)
组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
c(KI) | Υ | c(H2SO4) | Υ | ||||
1 | 298K | 1 mol/L | 5 mL | 0.1mol/L | 5 mL | 3滴 | l组和2组探究②__________对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
2 | 308K | 1 mol/L | 5 mL | 0.1mol/L | 5 mL | 3滴 | |
3 | 298K | 1 mol/L | 5 mL | ①___________ | 5 mL | 3滴 | |
(3)在上述实验中,三种溶液混合的顺序最合理的是_______(选填下列选项);应记录的是_________所需的时间。
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加 入淀粉溶液
入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com