
| A. | 小于0.23mol | B. | 等于0.23mol | ||
| C. | 0.23mol~0.46mol之间 | D. | 等于0.46mol |
分析 n(H2SO4)=0.025L×18.4mol/L=0.46mol,发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度逐渐降低,稀硫酸与铜不反应,以此解答.
解答 解:18.4mol•L-1H2SO4溶液中加入足量的铜片并加热发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
n(H2SO4)=0.025L×18.4mol/L=0.46mol,
随着反应的进行,硫酸浓度逐渐降低,稀硫酸与铜不反应,
则被还原的H2SO4的物质的量小于0.23 mol,
故选A.
点评 本题考查氧化还原反应的计算,侧重于硫酸的性质的考查,注意浓硫酸和稀硫酸性质的异同,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
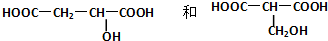 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si | B. | Ge | C. | Sn | D. | Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.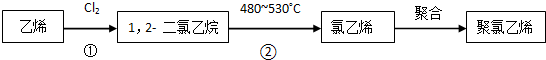
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
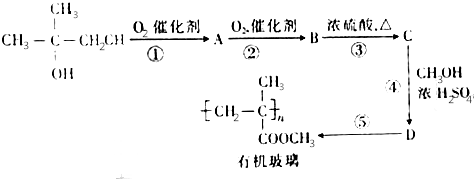
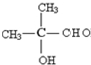 、C
、C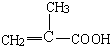
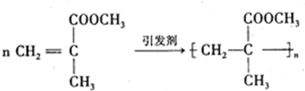 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种 | B. | 二种 | C. | 三种 | D. | 四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 | |
| B. | NaHCO3、Na2CO3、NH4HCO3三种固体受热均能产生气体 | |
| C. | Fe与稀硝酸、稀硫酸反应均有气体产生,说明Fe与两种酸均发生置换反应 | |
| D. | 稀硝酸、稀硫酸均不能将木炭氧化成二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com