
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
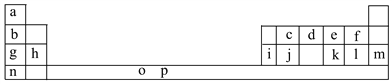
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___________________。
(2)d与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是__________________________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
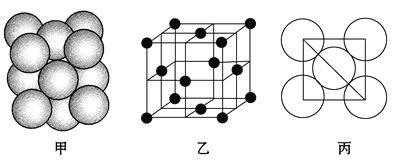
请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
【答案】 1s22s22p63s23p63d64s2 sp3 极性 电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量 Mn2+的3d轨道电子排布为半满状态,较稳定 12 4
【解析】(1)元素p为26号元素,为铁元素,其基态原子电子排布式为1s22s22p63s23p63d64s2;(2)a为H,d为N,二者化合生成NH3,分子中N原子含有一对孤对电子,价层电子对数是4,氮原子是sp3杂化。空间构型是三角锥形,所以是极性分子;(3)主要从电子跃迁角度解释,电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量,所以Mg单质在空气中燃烧发出耀眼的白光。(4)o是Mn元素,p是Fe元素,Mn2+的价电子排布为3d5,属于半充满稳定结构,难再失去一个电子,气态Fe2+的电子排布为3d6,失去一个电子后是半充满稳定结构。(5)i为Al原子,以Al原子为中心,每个面的面心处距Al原子最近且相等,共为![]() 12个原子。一个晶胞中Al原子数目为8×1/8+6×1/2=4。
12个原子。一个晶胞中Al原子数目为8×1/8+6×1/2=4。


科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:

(1)连接上述仪器的正确顺序是:E接 , 接 , 接 , 接F.____________
(2)气体发生装置中进行的反应化学方程式是_________________;当0.5mol MnO2参与反应时,被氧化的HCl的质量为____________,生成的Cl2在标准状况下的体积约为____________.
(3)在装置中:①饱和食盐水的作用是______________,②浓硫酸的作用是__________.
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉﹣KI试纸.如果有Cl2产生,可观察到的现象是__________________,写出反应方程式__________________.
(5)写出尾气吸收装置中进行的反应的化学方程式_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:

下列说法不正确的是
A. 固体2是氧化铁
B. X的化学式可以表示为Fe3C2
C. 溶液甲加热、蒸发、灼烧也可得到24.0g固体
D. X与足量的热浓硝酸反应有NO2和CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为 0.1molL﹣1.某同学进行了如下实验:

下列说法正确的是( )
A. 无法确定原试液中是否含有 Al3+、 Cl﹣
B. 滤液 X 中大量存在的阳离子有 NH4+、 Fe2+和 Ba2+
C. 无法确定沉淀 C 的成分
D. 原溶液中存在的离子为 NH4+、 Fe2+、 Cl﹣、 SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
C. 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) H1=a kJmol-1
②2NO(g)+2CO(g) N2(g)+ 2CO2(g) H2=b kJmol-1
则反应N2(g)+ O2(g)= 2NO(g)的H=____________kJmol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 ____________。
②在该温度下反应的平衡常数K=________。
③关于上述反应,下列叙述不正确的是_______(填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
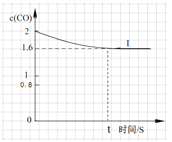
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。______________
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图
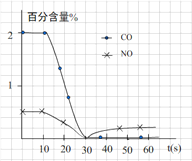
请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得某溶液中仅含有K+、Cu2+、SO42-、Cl-四种离子,其中K+、Cu2+、Cl - 三种离子的个数比为4 : 5 : 8,则K+与SO42-的物质的量比为 ( )
A.4:3
B.4:1
C.2:3
D.2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com