
向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入一定量的稀盐酸。下列离子方程式与事实不相符的是
A.OH―+CO32―+2H+=HCO3―+H2O B.2OH―+CO32―+3H+=HCO3―+2H2O
C.2OH―+CO32―+4H+=CO2↑+3H2O D.OH―+CO32―+3H+=CO2↑+2H2O
科目:高中化学 来源:2015-2016学年河北省高一上第一次月考化学试卷(解析版) 题型:选择题
某工厂排出的废液中含有Ba2+、Ag+、Cu2+,用①Na2SO4溶液,②NaOH溶液,③盐酸三种试剂将它们逐一沉淀并加以分离,加入试剂的正确顺序是
A.②③① B.②①③ C.①②③ D.③①②
查看答案和解析>>
科目:高中化学 来源:名师精品推荐(解析版) 题型:选择题
下列实验操作或方法中,不合理的是
A.用药匙取用少量二氧化锰粉末
B.向燃着的酒精灯中直接添加酒精
C.用焰色反应检验钠元素的存在
D.实验室将少量金属钠保存在煤油中
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省牡丹江市高三9月月考化学试卷(解析版) 题型:选择题
下列说法错误的是
A.浓硫酸具有强氧化性,但SO2气体可以用浓硫酸干燥
B.常温下实验室可以用稀硝酸与铁反应制取NO气体
C.王水溶解金的过程为氧化还原反应,还原产物为NO2
D.SiO2不仅能与氢氧化钠溶液反应,也能与氢氟酸反应
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第一次月考化学试卷(解析版) 题型:实验题
“8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)NaCN溶液呈碱性的原因是 (用离子方程式表示)
(2)下列选项错误的是
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
(3)H2O2有有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-) c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验。将CN-的浓度为0.2000 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
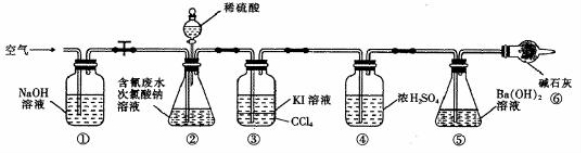
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl-
2CNO-+2H+ + 3C1O-=N2↑+2CO2↑+ 3C1-+H2O
(5)①和⑥的作用是 。
(6)反应结束后,缓缓通入空气的目的是 。
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置 反应前后的质量(从装置①到⑥中选择,填装置序号)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一下期末化学试卷(解析版) 题型:填空题
(25分)I .含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II.从煤和石油中可以提炼 出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油
出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油 状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_______,反应类型:________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与 浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_________,反应类型:________。
浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的 物质的量________(填A>B、A<B或A=B”)。
物质的量________(填A>B、A<B或A=B”)。
III.已知乙烯能发生以下转化:
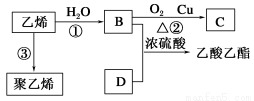
(1)C中含官能团名称_________;
(2)写出反应的化学方程式及反应类型:
B与D反应的化学方程式__________________;反应类型:________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高二下期末化学试卷(解析版) 题型:填空题
(1~4小题每空2分,5~6小题每空3分,共14分)A~G是几种烃的分子球棍模型(如图),据此回答下列问题:

(1)常温下含碳量最 高的气态烃是________(填字母)。
高的气态烃是________(填字母)。
(2)不能够发生 加成的烃有________种。
加成的烃有________种。
(3)一卤代物有两种的是________(填字母)。
(4)等质量的上述烃燃烧耗氧最多的是 (填字母)。
(5)写出实验室制C的化学方程式_______________。
(6)写出F发生溴代反应的化学方程式________ ____。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省富阳市高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
X、Y、Z、W、Q是五种短周期元素,它们在周期表中的位置如图。 下列说法不正确的是
X | |||||
Y | Z | W | |||
Q | |||||
A.Z与W可形成的化合物在5种以上
B.Z、W、Q三种元素形成的化合物,其水溶液一定呈中性
C.X、Y、Z、W形成的化合物的化学式可以是Y2X7W2Z
D.X与Y、Z、W均可形成原子个数比为2:1的化合物
查看答案和解析>>
科目:高中化学 来源:2016届西藏日喀则地区一中高三10月月考理综化学试卷(解析版) 题型:填空题
(16分)火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
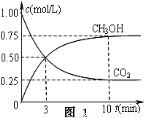
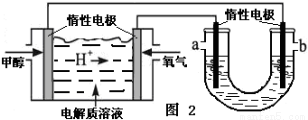
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL 某NaCl溶液,正极反应式为 。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为 mol。
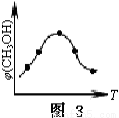
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是 (用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+) c(NH3·H2O)。(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com