
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源:不详 题型:单选题
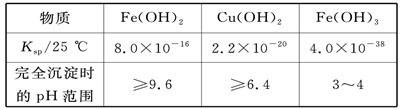
| A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 |
| B.向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuSO4溶液 |
| C.该溶液中c(SO)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4 |
| D.在pH=5的溶液中Fe3+不能大量存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
 CH3OH (g) ΔH=-90.8 kJ·mol-1
CH3OH (g) ΔH=-90.8 kJ·mol-1 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1 CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1| A.高温高压 |
| B.加入催化剂 |
| C.减少CO2的浓度 |
| D.增加CO的浓度E.分离出二甲醚 |
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
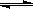 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。 CH3OH(g)。
CH3OH(g)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增大压强,活化分子百分数不变,化学反应速率增大 |
| B.升高温度,活化分子百分数增大,化学反应速率增大 |
| C.加入反应物,活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,活化分子百分数增大,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
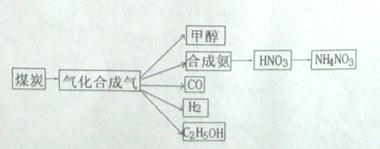
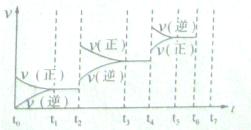
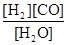 ,它所对应的化学反应为:
,它所对应的化学反应为: 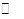 2C0(g),K1 ①
2C0(g),K1 ①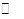 H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ②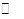 CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③ K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
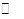 2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
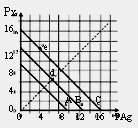
|
| A.A线是AgCl,C线是AgI | B.e点表示由过量的KI与AgNO3反应产生AgI沉淀 |
| C.d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D.B线一定是AgBr |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
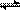 2Z ,达到平衡后, X的转化率不可能为
2Z ,达到平衡后, X的转化率不可能为| A.10% | B.15% | C.20% | D.25% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com