
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
分析 根据溶液呈电中性原则,溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),以此结合题中数据进行解答.
解答 解:溶液呈电中性,则:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),
由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有:3c(Al3+)+c(K+)=2c(SO42-),
带入数据可得:3×0.4mol/L+c(K+)=2×0.7mol/L,
解得:c(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L,
故选C.
点评 本题考查混合溶液中离子物质的量浓度的计算,题目难度中等,明确电荷守恒的含义及应用方法为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:多选题
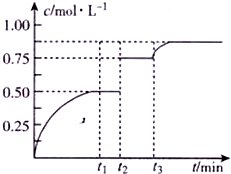 一定温度下,将1mo1X、1molY和1molW充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+W(s),t1时达到平衡.在t1、t2时刻分别改变影响反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1mo1X、1molY和1molW充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+W(s),t1时达到平衡.在t1、t2时刻分别改变影响反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )| A. | 反应方程式中的m=2 | |
| B. | t2时刻改变的条件是加人了催化剂或加压 | |
| C. | t3时刻改变的条件是移去少里物质W | |
| D. | t3时刻改变的条件可能是增加了X的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸除去水垢中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铜和浓硝酸反应:Cu+4H++2NO${\;}_{3}^{-}$═Cu2++2NO2↑+2H2O | |
| C. | 向氨水中通入过量SO2:2NH3•H2O+SO2═2NH${\;}_{4}^{+}$+SO${\;}_{3}^{2-}$+H2O | |
| D. | H2SO4溶液和Ba(OH)2溶液:H++SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀盐酸反应CO32-+2H+═CO2↑+H2O | |
| B. | 稀硫酸与氯化钡溶液反应Ba2++SO42-═BaSO4 | |
| C. | 氢氧化镁与稀硫酸反应OH--+H+═H2O | |
| D. | 铁钉放入硫酸铜溶液中2Fe+3Cu2+═2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
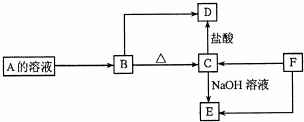
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
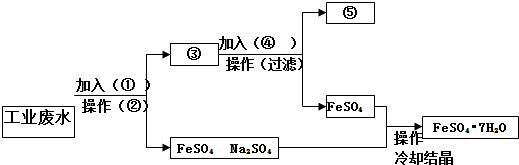
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 自发反应都是熵增大的反应 | |
| C. | 能自发进行的吸热反应一定是熵增大的反应 | |
| D. | 自发反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3的电离方程式:NaHCO3═Na++H++CO32- | |
| B. | CaCO3的沉淀溶解平衡表达式:CaCO3(s)?Ca2+(aq)+CO32-(aq) | |
| C. | NaHS发生水解的离子方程式:HS-+H2O?S2-+H3O+ | |
| D. | 碳酸的电离方程式:H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
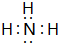 ;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).
;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com