
【题目】在某无色酸性溶液中能大量共存的一组离子是
A. NH4+、SO42-、Al3+、NO3- B. Na+、K+、HCO3-、NO3-
C. Na+、Ca2+、NO3- 、CO32- D. K+、Cu2+、NH4+、NO3-
科目:高中化学 来源: 题型:
【题目】日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如右。据图回答:

(1)作正极的是__________。
(2)负极的电极反应是_____________________________
(3)许多国家对废电池进行回收,其主要原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上“固定”和利用CO2能有效地减轻“温室效应”。
I.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):

回答下列问题:
(1)该反应在______条件下能自发进行(城编号)。
A.高温 B.低温 C.任何温度
(2)该反应在0 ~8 min内CO2的平均反应速率是_______。
(3)该反应的平街常数K=______________。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I改变的条件可能是_________。若实线对应条件下平衡常教为K,虚线I对应条件下平衡常数为K1,盛线II对应条件下平衡常数为K2,则K、K1和K2的大小关系是______。
II.己知25℃时,乙酸和碳酸的电离平衡常数如下表:

(1)用饱和氨水吸收CO2可得到NH4HCO3溶液,若已知CH3COONH4溶液pH=7,则NH4HCO3溶液显_____(填“酸性”、“碱性”或“中性”)。
(2)25℃时,在0 . lmol/L乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的
pH=6,那么混合液中 =_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
=_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从烷烃(CnH2n+2),烯烃(CnH2n),二烯烃(CnH2n--2)的通式分析,得出碳氢原子的个数与分子中所含双键有一定关系,某种烃的分子式为CxHy,其中所含双键数目最多为
A.y/2 B.(y-x)/2 C.(y+2-x)/2 D.(2x+2-y)/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入6mol/L的H2SO4溶液中,乙同学将两电极放入6mol/L的NaOH溶液中,装置如图所示。

(1)写出①中正极的电极反应式:___________。
(2)②中负极材料为_______,总反应的离子方程式为___________ 。
(3)甲、乙两同学都认为“如果构成原电池的电极材料都是金属,则作负极的金属应比作正极的金属活泼”,则甲同学得出的结论是_______的活动性更强,乙同学得出的结论是______的活动性更强。(填元素符号)
(4)由该实验得出的下列结论中,正确的是________(填字母)。
A.利用原电池反应判断金属活动性强弱时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)B装置有三种功能:①均匀混合气体;②_____________③_____________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应_____________。
(3)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
(4)D装置的石棉中均匀混有KI粉末,其作用是___________________。
(5)E装置的作用是___________________(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是

A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向纯水中通入Cl2至饱和,再逐滴滴加0.1mol/L的NaOH溶液,实验过程中得到如下图所示的pH变化曲线。下列有关说法正确的是
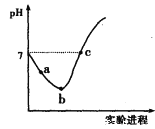
A. pH=7时,一定有c(Na+)=c(Cl-)+c(ClO-)
B. 从a点到b点,Cl2在水中的溶解度增大
C. b点溶液中:c(H+)=c(Cl-)+c(OH-)+c(HClO)
D. 从b点到c点,溶液中![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com