
氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 |
甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ①??????????????????????????????? |
乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③??????????????????????????????? |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____??????????????????????????????????????? ,硬质玻璃管中氨发生催化氧化反应的化学方程式为????????????????????????? 。

(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为?????????????????????? ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有???????????????????? 。
??? (4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。

(1)① 2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。(2分)②B? (1分)
CaCl2+2H2O+2NH3↑。(2分)②B? (1分)
③固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O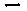 NH3·H2O
NH3·H2O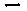 NH4+? ? +OH-向生成NH3的方向移动。(2分)
NH4+? ? +OH-向生成NH3的方向移动。(2分)
(2)玻璃管中出现红棕色,干燥管中固体变蓝(2分)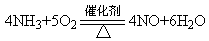 ?? (2分)
?? (2分)
(3)先产生白色沉淀,后消失;溶液最后变成红色 (2分)Ag(NH3)2+、NO3-? (2分)
(4)方案错误;反应产生的NH3全部被H2SO4吸收,不能进行后续反应。(2分)
【解析】
试题分析:(1)①氢氧化钙、氯化铵制取氨气的化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
②浓氨水、氢氧化钠制取氨气应选择B装置,
③氨水中存在NH3+H2O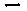 NH3·H2O
NH3·H2O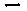 NH4+? ? +OH-的平衡,加入NaOH固体,一是OH-浓度增大,平衡逆向移动;二是NaOH固体溶于水后放出大量的热,促使NH3的挥发;
NH4+? ? +OH-的平衡,加入NaOH固体,一是OH-浓度增大,平衡逆向移动;二是NaOH固体溶于水后放出大量的热,促使NH3的挥发;
(2)氨气与氧气在催化剂作用下生成一氧化氮气体,该气体遇空气变为红棕色二氧化氮;同时还有水生成,所以无水硫酸铜变蓝色;
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,氨气溶于水后,溶液显碱性,与Ag+反应生成氢氧化银沉淀,继续通氨气产生氢氧化二氨合银,沉淀溶解,最终溶液变红色;反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子Ag(NH3)2+、NO3-?
(4)不正确,反应产生的氨气全部被浓硫酸吸收,无法进行后面的反应
考点:考查氨气的不同制法、氨气的化学性质


科目:高中化学 来源: 题型:阅读理解

| 10-7b |
| a-b |
| 10-7b |
| a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 10-7y |
| x-y |
| 10-7y |
| x-y |
查看答案和解析>>
科目:高中化学 来源:山东省济南市2010届高三第一次模拟考试化学试卷 题型:单选题
(14分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: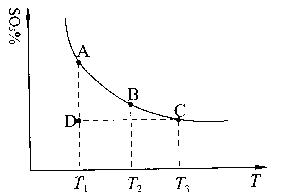
 ①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
查看答案和解析>>
科目:高中化学 来源:2010年浙江省慈溪中学高二第二学期期中考试(1—3班)化学试题 题型:填空题
(19分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
若在固定容积的密闭容器中发生反应,起始时SO2和O2分别为1mol和0.5mol,达到平衡时SO2的转化率为90%。则从SO3开始进行反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量 ,转化率为
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,
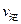 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①写出自然界固氮的化学反应方程式: 。
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省高三上学期期末复习(二)(理综)化学部分 题型:填空题
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H
0(填“>”或“<”);若在恒温、
2SO3(g)的△H
0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);

②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,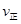
 (填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,
请写出工业合成氨的热化学反应方程式: 。
(△H的数值用含字母a、b的代数式表示)

②氨气溶于水得到氨水。在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com