用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.6.2克白磷分子中含P-P键为0.6NA
B.10.0 mL18.0mol/L的浓硫酸中氢离子数为0.36 NA
C.6.4 g S6与S8的混合物中所含S原子数一定为0.2 NA
D.80 mL 10mol?L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA
【答案】
分析:A.1mol白磷分子中含6molP-P键;
B.浓硫酸里,大部分的是以分子形式存在;
C.S
6与S
8都是单质,则硫原子的物质的量为
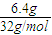
;
D.依据浓盐酸随着反应进行,浓度变稀后不再与二氧化锰反应进行解答.
解答:解:A.1mol白磷分子中含6molP-P键,6.2g白磷晶体物质的量=

=0.05mol,分子中含有的P-P键数约是0.3N
A,故A错误;
B.电解质在水中的电离靠水分子的作用,浓硫酸里只含有很少的水,硫酸大部分的是以分子形式存在,只有少部分电离,所以,10.0 mL18.0mol/L的浓硫酸中氢离子数远小于0.36 N
A,故B错误;
C.S
2和S
8的混合物中只有S原子,则硫原子的物质的量为
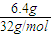
=0.2mol,则所含硫原子数一定为0.2N
A,故C正确;
D.80 mL 10mol?L
-1浓盐酸含0.8molHCl,浓盐酸与足量MnO
2混合加热,随着反应进行浓盐酸浓度变稀后不再与二氧化锰进行反应,所以0.8mol HCl不能全部反应,故转移电子数不是0.4N
A,故D错误;
故选C.
点评:本题考查阿伏伽德罗常数的计算,考查知识点全面,明确物质的构成、化学键的数目、反应的隐含条件等来解答,属于易错题,难度不大.

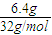 ;
; =0.05mol,分子中含有的P-P键数约是0.3NA,故A错误;
=0.05mol,分子中含有的P-P键数约是0.3NA,故A错误;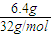 =0.2mol,则所含硫原子数一定为0.2NA,故C正确;
=0.2mol,则所含硫原子数一定为0.2NA,故C正确;

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案