
| A. | 总反应可表示为2SO2+O2+2H2O$\stackrel{NO_{2}}{→}$2H2SO4 | |
| B. | 还可能发生的反应有4NO2+O2+2H2O→4HNO3 | |
| C. | NO2由反应N2+O2$\stackrel{放电}{→}$NO2生成 | |
| D. | 还可能发生的反应有4NO+3O2+2H2O→4HNO3 |
分析 由:①NO2+SO2→NO+SO3,②2NO+O2→2NO2,③SO3+H2O→H2SO4,可知二氧化氮在反应中起催化剂作用,二氧化氮与水反应生成硝酸和一氧化氮,一氧化氮与氧气反应生成硝酸,据此解答.
解答 解:A.由①NO2+SO2→NO+SO3,②2NO+O2→2NO2,③SO3+H2O→H2SO4,可知二氧化氮在反应中起催化剂作用,所以总反应可表示为2SO2+O2+2H2O$\stackrel{NO_{2}}{→}$2H2SO4,故A正确;
B.二氧化氮与氧气反应生成硝酸与一氧化氮,一氧化氮与氧气反应生成二氧化氮,两个方程式合消并掉一氧化氮得:4NO2+O2+2H2O→4HNO3,故B正确;
C.氮气与氧气化合生成一氧化氮,故C错误;
D.一氧化氮与氧气反应生成二氧化氮,二氧化氮与氧气反应生成硝酸与一氧化氮,两个方程式合并消掉二氧化氮得:4NO+3O2+2H2O→4HNO3,故D正确;
故选:C.
点评 本题考查了物质之间的反应,明确二氧化硫、二氧化氮、一氧化氮的性质是解题关键,题目难度不大.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | R与Z形成的是共价化合物 | |
| B. | 原子半径:W>R>Z | |
| C. | W的气态氢化物的热稳定性比Y的弱 | |
| D. | R的最高价氧化物的水化物酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
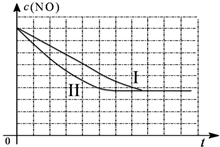
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:n (HCl)=1 mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 | |
| B. | 图2:n (NaOH)=1 mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| C. | 图3:n (O2)=1 mol,高温下C和O2在密闭容器中的反应产物 | |
| D. | 图4:n (HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
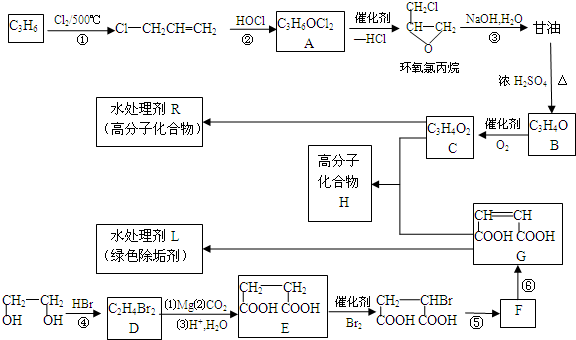
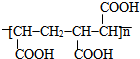 .
.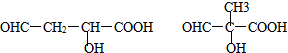
 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
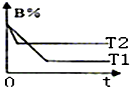 密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )
密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )| A. | △H<0,T1<T2 | B. | △H>0,T1<T2 | C. | △H<0,T1>T2 | D. | △H>0,T1>T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 该反应NH3被还原 | D. | 生成1 mol N2有6 mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com