
| 0.4 |
| 0.01 |
| 0.4 |
| 0.01 |
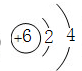 ,硫原子的结构示意图为
,硫原子的结构示意图为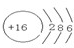 ,故答案为:
,故答案为: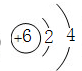 ;
;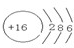 ;
; 

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.| 1 |
| 2 |
| 1 |
| 2 |
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、只有③ | B、只有①④ |
| C、只有①②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤化氢中,HF沸点较高,是由于HF分子间存在氢键 |
| B、邻羟基苯甲醛的熔沸点比对羟基苯甲醛的熔沸点低 |
| C、氨水中有分子间氢键 |
| D、氢键X-H…Y的三个原子总在一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3CH2OH
| |||
B、CH3CHBrCH3+NaOH
| |||
C、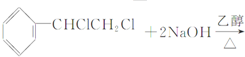  | |||
D、2CH3OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m+2、10+n |
| B、m、n |
| C、3、7 |
| D、m-2、10-n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com