
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已如:2SO2(g)+O2(g)2SO3(g) △H=-196.6kJmol-1
2NO(g)+O2(g)2NO2(g) △H=-113.0kJmol-1
请写出NO2与SO2反应生成SO3(g)和NO的热化学力程 式_________________________。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________。(填字母序号)
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO2的同时生成1mlINO2
(2)①工 业上一般以CO和H2为原料合成甲醇。该反应的热化学方程式为:CO(g)+2H2(B)![]() CH3OH(g)△H=-99kJmol-1。则反应物的总能量__________(填高于、低于或者等于)生成物的总能量。
CH3OH(g)△H=-99kJmol-1。则反应物的总能量__________(填高于、低于或者等于)生成物的总能量。
②在恒温条件下体积为2L的密闭容器中,将1mol CO与3molH2的混合气体在催化剂作用下发生反应生成甲醇。2min时制得生成CH3OH0.2mol,则0~2min的平均反应速率v(H2)=_________。CO 的转化率为_______。反应前后的压强比为____________。
③恒温恒容时,改变下列条件能加快以上反应的速率的是__________(填字母序号)。
a.充入情性气体 b.增加CO的量 C.升高温度 d.减小H2的量
【答案】 NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-41.8kJ/mol bd 高于 0.l mol·L-1·min-1 20% 10:9 bc
SO3(g)+NO(g) △H=-41.8kJ/mol bd 高于 0.l mol·L-1·min-1 20% 10:9 bc
【解析】试题分析:(1) ①根据盖斯定律写NO2与SO2反应生成SO3(g)和NO的热化学力程式;②根据化学平衡的特征分析平衡状态;(2)①根据热化学方程式,焓变小于0,反应放热;②根据![]() 计算反应速率;转化率=变化量÷初始量;同温同体积,压强比等于物质的量比;③根据影响反应速率的因素分析;
计算反应速率;转化率=变化量÷初始量;同温同体积,压强比等于物质的量比;③根据影响反应速率的因素分析;
解析:(1) ①2SO2(g)+O2(g)2SO3(g) △H=-196.6kJmol-1;②2NO(g)+O2(g)2NO2(g) △H=-113.0kJmol-1,根据盖斯定律①×![]() -②×
-②×![]() 得NO2(g)+SO2(g)
得NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-41.8kJ/mol;②a.该反应前后气体物质的量不变,压强是恒量,体系压强保持不变不一定平衡,故a错误;b.混合气体颜色保持不变,说明NO2浓度不变,一定平衡,故b正确;c.SO3和NO都是生成物,体积比一直保持1:1,故c错误; d.每消耗1molSO2的同时生成1mlINO2,说明正逆反应速率相等,一定达到平衡状态,故d正确。(2)①根据热化学方程式,焓变小于0,反应放热,应物的总能量高于生成物的总能量;②
SO3(g)+NO(g) △H=-41.8kJ/mol;②a.该反应前后气体物质的量不变,压强是恒量,体系压强保持不变不一定平衡,故a错误;b.混合气体颜色保持不变,说明NO2浓度不变,一定平衡,故b正确;c.SO3和NO都是生成物,体积比一直保持1:1,故c错误; d.每消耗1molSO2的同时生成1mlINO2,说明正逆反应速率相等,一定达到平衡状态,故d正确。(2)①根据热化学方程式,焓变小于0,反应放热,应物的总能量高于生成物的总能量;②
根据![]() ,v(H2)=
,v(H2)= ![]() 0.l mol·L-1·min-1 ;
0.l mol·L-1·min-1 ; ![]() 20%;同温同体积,压强比等于物质的量比,反应前后的压强比为(0.5+1.5):(0.4+1.3+0.1)=10:9;③a、恒温恒容时,充入情性气体,浓度不变,反应速率不变,故a错误; b.增加CO的量,反应物浓度增大,反应速率加快,故b正确;c.升高温度,反应速率加快,故c正确; d.减小H2的量,反应物浓度减小,反应速率减小,故d错误。
20%;同温同体积,压强比等于物质的量比,反应前后的压强比为(0.5+1.5):(0.4+1.3+0.1)=10:9;③a、恒温恒容时,充入情性气体,浓度不变,反应速率不变,故a错误; b.增加CO的量,反应物浓度增大,反应速率加快,故b正确;c.升高温度,反应速率加快,故c正确; d.减小H2的量,反应物浓度减小,反应速率减小,故d错误。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】酶在酶促反应中能催化特定的底物(酶进行催化反应的反应物)反应,与酶的活性中心有关。酶的活性中心往往与底物分子在空间结构上具有特殊的匹配关系,当酶与底物结合时,启动化学反应的发生。请据图回答问题:

(1)上图所示过程能说明酶具有 的特点。
(2)酶能提高反应速率的机理是 ,使底物分子从常态转变为容易发生化学反应的活跃状态。
(3)下列符合图示反应类型的有 。
A.氨基酸a+氨基酸b→二肽+H2O
B.麦芽糖+H2O→葡萄糖
C.CO2+H2O→(CH2O)+O2
D.H2O2→H2O+O2
(4)请在下表中写出两个与酶有关的实验中的自变量:
序号 | 实验名称 | 自变量 | 因变量 |
① | 探索淀粉酶对淀粉和蔗糖水解的作用 | 加斐林试剂水浴加热,有无砖红色(沉淀)出现 | |
② | 研究温度对淀粉酶活性的影响 | 加碘后溶液颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl,下列关系正确的是( )
A.体积大小:④>③>②>①
B.密度大小:④>②>③>①
C.原子数目:③>①>④>②
D.质量大小:④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 苯酚钠溶液中通入少量氧化碳:2C6H5O- +CO2+H2O![]() 2C6H5OH+CO32-
2C6H5OH+CO32-
B. 苯酚与氢氧化钠溶液反应:C6H5OH +OH-![]() C6H5O-+H2O
C6H5O-+H2O
C. 醋酸和碳酸钠溶液反应:CO32-+2H+=CO2↑+H2O
D. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是( )
A. 用分液漏斗分离溴和苯
B. 分馏石油时,将温度计插入石油液面下
C. 取样灼烧,可以鉴别白色纺织品是棉织品还是羊毛制品
D. 直接往淀粉水解液中加入新制氢氧化铜悬浊液并且加热,可检验淀粉水解产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: 
(1)装置A中仪器①的名称是 , 装置D中仪器②的名称是 .
(2)从氯化钾溶液中得到氯化钾固体,应选择装置(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置;从碘水中分离出I2 , 选择装置 , 该装置的主要仪器名称是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加水溶解,所加的水量应为: (填选项)
A.多加水配成较稀的溶液
B.加入适量的水至能溶解的固体溶解即止
(2)将(1)中配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择①Na2CO3溶液②KOH溶液③AgNO3溶液④NaOH溶液⑤NaHCO3溶液⑥BaCl2溶液,则正确的试剂和加入的顺序应为:(填选项)
A.①②③B.②⑥⑤C.④⑥①D.①④⑥E.⑥①④F.⑥②⑤
将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用:
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、和
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L的偏差是:(填“偏大”、“偏小”、“无影响”)
①在上述(2)步中没有使用盐酸处理滤液,结果会
②没有对烧杯和玻璃棒进行洗涤,结果会
③定容时俯视凹液面,结果会
④上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线,结果会 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在不同条件下酶促反应速率的变化曲线,请分析回答下列问题
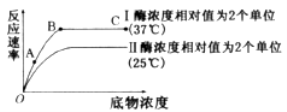
(1)酶促反应速率可以用单位时间单位体积的 来表示。
(2)Ⅱ和Ⅰ相比,酶促反应速率慢,这是因为 。
(3)图中AB段和BC段影响反应速率的主要限制因子分别是 和 。
(4)为了探究pH对酶活性的影响,有人做了如下实验:
试管编号 | 加入物 | 现象 |
1 | 2ml猪肝研磨液 + 1ml蒸馏水 + 2ml 3%的过氧化氢 | 放出大量的气泡 |
2 | 2ml猪肝研磨液 + 1ml NaOH + 2ml 3%的过氧化氢 | 无气泡 |
3 | 2ml猪肝研磨液 + 1ml HCl + 2ml 3%的过氧化氢 | 无气泡 |
实验中的底物是 ,自变量是 ,因变量是 ,无关变量是 (至少写出一个)。
(5)有同学准备以H2O2为材料来研究温度对H2O2酶活性的影响?你认为是否妥当? ;原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 自然界中硅以游离态和化合态两种形式存在
B. 二氧化硅有结晶形和无定形两种存在形态
C. 石英、水晶、玛瑙都是结晶形的
D. 无定形的二氧化硅主要存在于硅藻土中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com