
ll.在一种酸性溶液中存在NO3-、I-、CI-、Fe3+中一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
①一定含有I-,不能确定是否有CI- ②一定含有NO3-
③不含有Fe3+ ④ 一定含有I-、NO3-和CI-
A.① B.②③ C.④ D.①③
科目:高中化学 来源: 题型:阅读理解
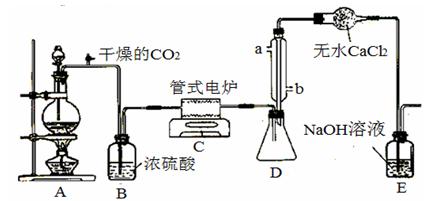
Ⅰ、 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是某科研小组制备TiCl4的反应装置:

其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号) ;
(2)装置A中的反应的离子方程式为 ;
(3)C装置中的反应的化学方程式为 。
Ⅱ、若该科研小组将刚吸收过少量SO2的NaOH溶液注入装置E对上述实验的尾气进行吸收处理,则吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl![]() 、CO32-、OH
、CO32-、OH![]() 和SO
和SO![]() 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
(1)提出合理假设:
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3: 。
(2)设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:
a.3mo l![]() L-1 H2SO4 b.0.01mol
L-1 H2SO4 b.0.01mol![]() L-1 KMnO4 c.1mol
L-1 KMnO4 c.1mol![]() L-1 BaCl2
L-1 BaCl2
d.淀粉—KI溶液 e.酚酞试剂 f.品红溶液
| 实验步骤 |
|
| 步骤1:取少量吸收液于试管中,滴加3 mol | |
| 步骤2:向A试管中滴加1~2滴 (填序号)。 | 若溶液 ,则假设1成立。 否则,则假设2或3成立。 |
| 步骤3:向B试管中滴加1~2滴 (填序号)。 | 若溶液 ,则假设3成立。 否则,结合步骤2,则假设2成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ、 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是某科研小组制备TiCl4的反应装置:
其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号) ;
(2)装置A中的反应的离子方程式为 ;
(3)C装置中的反应的化学方程式为 。
Ⅱ、若该科研小组将刚吸收过少量SO2的NaOH溶液注入装置E对上述实验的尾气进行吸收处理,则吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl![]() 、CO32-、OH
、CO32-、OH![]() 和SO
和SO![]() 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
(1)提出合理假设:
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3: 。
(2)设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:
a.3mo l![]() L-1 H2SO4 b.0.01mol
L-1 H2SO4 b.0.01mol![]() L-1 KMnO4 c.1mol
L-1 KMnO4 c.1mol![]() L-1 BaCl2
L-1 BaCl2
d.淀粉—KI溶液 e.酚酞试剂 f.品红溶液
| 实验步骤 |
|
| 步骤1:取少量吸收液于试管中,滴加3 mol | |
| 步骤2:向A试管中滴加1~2滴 (填序号)。 | 若溶液 ,则假设1成立。 否则,则假设2或3成立。 |
| 步骤3:向B试管中滴加1~2滴 (填序号)。 | 若溶液 ,则假设3成立。 否则,结合步骤2,则假设2成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
|
| ⅠA |
| 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
| 2 |
|
|
|
|
| ② | ④ |
|
| 3 | ⑤ |
| ③ |
|
| ⑥ | ⑦ |
|
(1)④、⑥、⑦的离子半径由大到小的顺序为 。
(2)1971年美国科学家通过细冰获得含元素④的含氧酸(HXO),在与水反应时,两种分子中的共价键分别断裂成两部分,再重新组合,写出该反应的化学方程式 。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为 。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气
体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②常温下,若电解lL 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
③若仅电解l L0.1 mol/L A溶液,图中各步反应均为完全转化,而各物质在反应过程中没有损耗,则混合物X中含有的物质有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
ll. 在一种酸性溶液中存在NO3-、I-、CI-、Fe3+中一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
①一定含有I-,不能确定是否有CI- ②一定含有NO3-
③不含有Fe3+ ④ 一定含有I-、NO3-和CI-
A.① B.②③ C.④ D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com