
分析 (1)16g甲烷(CH4)的物质的量为1mol,燃烧时消耗2mol氧气生成CO2和液态水时放热890.3kJ,书写热化学方程式时要标明物质的聚集状态;
(2)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据热化学方程式书写方法写出热化学方程式,标注物质聚集状态和对应焓变;
(3)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(4)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(5)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol
根据盖斯定律将方程式变形(3×①-②-2×③)÷6得到;
(6)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.碳单质、氢气、甲烷的热化学方程式分别为:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol;
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol,根据盖斯定律计算得到所需热化学方程式.
解答 解:(1)1mol甲烷完全燃烧生成二氧化碳和液态水放热890.3KJ;故燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1;
(2)在101kPa时,H2在1mol O2中完全燃烧生成2mol液态水,放出571.6kJ的热量,则1molH2在O2中完全燃烧,生成1mol液态水,放出285.8kJ热量,表示H2燃烧热的化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,则生成1mol水所放出的热量即中和热△H=-57.3kJ/mol,则中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(4)在反应N2(g)+3H2(g)=2NH3(g)中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,所以N2(g)与H2(g)反应生成NH3(g)的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1;
(5)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol
根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:
Fe(s)+CO(g)═Fe(s)+CO2(g),
△H=(3×△H1-△H2-2×△H3)÷6=-11KJ/mol.
故答案为:FeO(s)+CO(g)═Fe(s)+CO2(g),△H=-11KJ/mol;
(6)实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol,则它们的热化学反应方程式分别为:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol;
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol;
根据盖斯定律,由③-①-②×2得,CH4(g)=C(s)+2H2(g)=,△H=(-890.3kJ/mol)-(-393.5kJ/mol)-(-285.8kJ/mol)×2=+74.8kJ/mol,
所以CH4(g)分解为H2(g)、C(s)的热化学方程式为:CH4(g)=C(s)+2H2(g)△H=+74.8kJ/mol;
故答案为:CH4(g)=C(s)+2H2(g)△H=+74.8kJ/mol.
点评 本题主要考查了热化学方程式的书写及其盖斯定律的应用,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.


科目:高中化学 来源: 题型:多选题
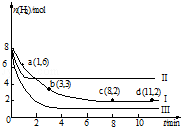 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )| A. | 该反应在0~8 min内CO2的平均反应速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% | |
| C. | 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 | |
| D. | 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 变化过程 | △H | △S |
| 4Fe(s)+3O2(g)=2Fe2O3(s) | <0 | |
| CaCO3(s)分解为CaO(s)和CO2(g) |
| 时间/min | A | B | C | D |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单气态氢化物沸点Y>X>W | |
| B. | 原子半径Z>Y>X>W | |
| C. | Y元素可能位于第二周期第ⅦA族 | |
| D. | Y元素与其它三种元素均可形成多种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{27m}{v}$mol/L | B. | $\frac{m}{9v}$mol/L | C. | $\frac{m}{27v}$mol/L | D. | $\frac{m}{18v}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 金属氧化物一定不能与碱发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com