
分析 (1)M转化为N是吸热反应,所以N的能量高,能量越高越不稳定;根据反应热与化学计量数成正比关系以及注明物质的聚集状态与反应热书写热化学方程式;
(2)根据放出的热量计算参加反应氮气物质的量,进而计算氨气转化率;
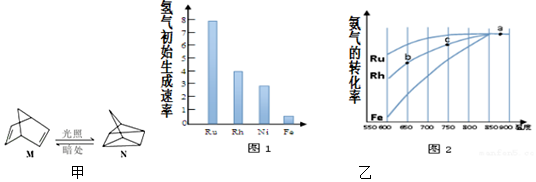
氢气初始生成速率越大,说明催化剂催化性能越高;
点b、c均未达到平衡,相同时间,C点温度较高,反应速率较快,故C点的氨气的转化率较高;
催化剂不影响平衡移动,平衡时转化率不变,Ni的催化性能比Fe高,但比Rh低,相同温度下氨气转化率高于催化剂Fe的、小于催化剂Rh的.
解答 解:(1)M转化为N是吸热反应,所以N的能量高,能量越高越不稳定,能量越低越稳定,故稳定性M>N,有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
故答案为:>;2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
(2)参加反应氨气物质的量为2mol×$\frac{60.1kJ}{92.4kJ}$=1.3mol,故氨气转化率为$\frac{1.3mol}{2mol}$×100%=65%;
氢气初始生成速率越大,说明催化剂催化性能越高,由图可知Ru的催化性能最好;
点b、c均未达到平衡,相同时间,C点温度较高,反应速率较快,故C点的氨气的转化率较高;
催化剂不影响平衡移动,平衡时转化率不变,Ni的催化性能比Fe高,但比Rh低,相同温度下氨气转化率高于催化剂Fe的、小于催化剂Rh的,Ni催化分解氨气过程的总趋势曲线如图: ,
,
故答案为:65%;Ru;点b、c均未达到平衡,相同时间,C点温度较高,反应速率较快,故C点的氨气的转化率较高; .
.
点评 本题考查化学反应中能量变化、热化学方程式书写、化学平衡计算、化学平衡图象等,侧重考查分析解决问题能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,NA个SO3的体积为22.4 L | |
| B. | 1 mol Fe与足量的HCl溶液反应,转移的电子数为3NA | |
| C. | 2 L 1 mol•L-1的H3PO4溶液中所含的H+数为6NA | |
| D. | 标准状况下22.4 L Cl2通入足量的石灰乳制备漂白粉,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠投入水中立即熔化成闪亮的小球,说明反应放热且钠的熔点低 | |
| B. | 钠在空气中燃烧生成淡黄色的Na2O2 | |
| C. | 金属钠可以将铜从其盐溶液中置换出来 | |
| D. | 实验后剩余的钠块能放回原试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17gNH3所含中子数目为10 NA | |
| B. | 常温常压下,22 g氧气和26 g臭氧所含的氧原子总数为3NA | |
| C. | 常温常压下,18g H2O含有的电子总数为8NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化 | B. | 还原 | C. | 催化 | D. | 提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com