
【题目】常温下,向Ba(OH)2和NaOH混合溶液中缓慢通入CO2至过量(溶液温度变化忽略不计),生成沉淀物质的量与通入CO2体积的关系如下图所示。下列说法不正确的是
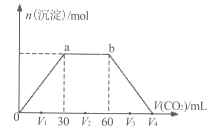
A. b点时溶质为NaHCO3
B. 横坐标轴上V4的值为90
C. V1、V2、V3时,溶液中c(Ba2+)·c(CO32-)相等
D. 原混合物中n[Ba(OH)2]:n(NaOH)=1:2
【答案】D
【解析】
向NaOH和Ba(OH)2的混合溶液中通入CO2,二氧化碳先和氢氧化钡反应生成碳酸钡沉淀,当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠,当氢氧化钠完全反应后,继续通入二氧化碳,二氧化碳和碳酸钠、水反应生成碳酸氢钠,当碳酸钠完全反应后,继续通入二氧化碳,二氧化碳和和碳酸钡、水反应生成可溶性的碳酸氢钡。
A项、ab段发生反应为2OH-+CO2=CO32-+H2O、CO32-+H2O+CO2=2HCO3-,所以b点溶液中溶质为NaHCO3,故A正确;
B项、发生反应Ba2++2OH-+CO2=BaCO3↓+H2O时消耗30mL的二氧化碳,发生反应NaOH+CO2=NaHCO3时消耗30mL的二氧化碳,发生反应BaCO3+CO2+H2O=Ba2++2HCO3-时消耗30mL的二氧化碳,所以V4为90mL,故B正确;
C项、BaCO3的溶度积Ksp= c(Ba2+)·c(CO32-),温度不变,溶度积不变,故C正确;
D项、发生反应Ba2++2OH-+CO2=BaCO3↓+H2O时消耗30mL的二氧化碳,发生反应NaOH+CO2=NaHCO3时消耗30mL的二氧化碳,发生反应BaCO3+CO2+H2O=Ba2++2HCO3-时消耗30mL的二氧化碳,所以原混合溶液中Ba(OH)2和NaOH的物质的量之比为30:(60-30)=1:1,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是 ( )。

A. a为CH4,b为CO2
B. ![]() 向负极移动
向负极移动
C. 此电池在常温时也能工作
D. 正极电极反应式为O2+2CO2+4e-===2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)在温度t1时达到平衡,平衡时C1(CO)=C1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为C2(CO)和C2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,平衡时C1(CO)=C1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为C2(CO)和C2(H2O),平衡常数为K2,则
A. K1和K2的单位均为mol/L B. K1 < K2
C. C2(CO) = C2(H2O) D. C1(CO) > C2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。


(1)仪器D的名称是________。安装F中导管时,应选用图2中的________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是_____________________________________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为________________________________________________________________________。
在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是
________________________________________________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是________________,原因是________________________________________________________________________。

图3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述不符合生产实际的是( )
A.电解熔融的氯化钠制取金属钠,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在锌锰干电池中,用锌作负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是( )
A. 17gH2O2所含非极性键数目为0.5NA
B. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
C. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
D. 100gCaS和CaSO4的混合物中含有32g硫,则含有的氧原子数为1.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
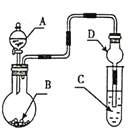
A. 若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B. 实验仪器D可以起到防止溶液倒吸的作用
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液中先产生白色沉淀,然后沉淀又溶解
D. 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com