
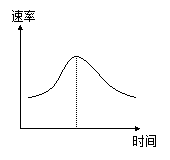
氯酸钢和亚硫酸氢饷发生氧化还原反应: CI03- + 3 HS03- = 3S042- + 3H + + Cl- ,下图为该反应速率随时间变化  的图像。图中V(CI03-) 是用CI03-在单位时间内的物质的量浓度的变化来表示的反应速率。则下列说法不正确的是
的图像。图中V(CI03-) 是用CI03-在单位时间内的物质的量浓度的变化来表示的反应速率。则下列说法不正确的是
A.反应开始时速率增大可能是c( H + )增大引起的
B.若坐标改为u( CI-) 时,速率时间曲线和上图曲线完全重合
C.后期反应速率下降的原因是反应物浓度减少
D.图中阴影部分"面积"为t1至t2时间内CI03-的物质的量的减少值
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。

(1)反应开始时反应速率加快的原因是_______________________________________。
(2)反应后期反应速率下降的原因是_________________________________________。
(3)若纵坐标表示的某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示_________________________ _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)反应开始时,反应速率加快的原因是_____________________________________________。
(2)反应后期,反应速率又下降的原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)
和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随
c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3-![]() Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
(1)反应开始时反应速率加快的原因是 ![]()
(2)反应后期反应速率下降的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3-![]() Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
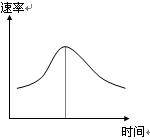
(1)反应开始时反应速率加快的原因是 ![]() ;
;
(2)反应后期反应速率下降的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com