
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、氯水。
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | ____ | 存在Fe3+ |
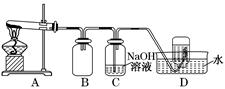
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:实验题
氨水是一种的常用的化学试剂。
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少 量氨气。已知:NH3·H2O+CaO=Ca(OH)2+NH3↑。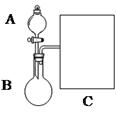
①生石灰应该装在 (填A或B)。
②试从电离平衡角度分析该实验中氨气逸出的原因: 。
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置。
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显。影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二: 。
②你设计实验验证上述影响因素一,完成下表中内容。
提供试剂:乙醛、2%稀氨水、 0.25mol/L NaOH溶液、盐酸 、 2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液。 | |
| 2 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2均为止水夹,夹持装置已略去)。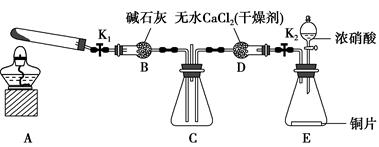
(1)E装置中制取NO2的化学反应方程式是____________________________
____________________________________________。
(2)若NO2能够被NH3还原,预期在C装置中观察到的现象是________________________________________________________________。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为有以下三种可能:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③______________________________________________________________。
(4)此实验装置中一个明显的缺陷是__________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:________________________________________________________。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换成Na2O2,另选F装置(如图所示),重新组装进行实验。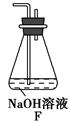
①装置的合理连接顺序是(某些装置可以重复使用)________。
②实验过程中,B装置中的粉末由淡黄色逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入________,振荡 | | 存在Fe2+ |

| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的最佳物质的量之比为________ ;为了吸收该反应中产生的尾气,可选择的最佳装置是________(填序号)。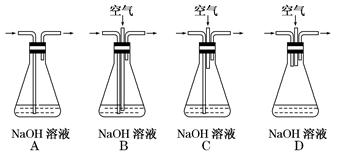
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计。
方案1:以空气为氧化剂。将铜粉在仪器N中反复灼烧,使铜与空气充分反应生成氧化铜,再使氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与烯硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,再通入空气或氧气,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部转化为Fe(OH)3沉淀(一般当铁离子的浓度下降到10-5mol·L-1时,就认为沉淀完全),然后过滤、浓缩、结晶。
(已知:常温下,Ksp[Cu(OH)2]=10-22,Ksp[Fe(OH)3]=10-38)
请回答下列问题:
①方案1中仪器N的名称是________。
②方案2中为了使铁元素全部沉淀,应调节pH至少为________。
③方案2中甲物质可选用________(填序号)。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E.Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。(固定装置已略去)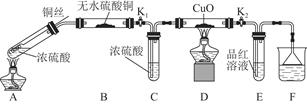
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学习小组设计用如图装置验证二氧化硫的化学性质。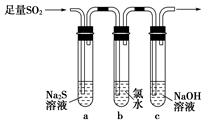
(1)能说明二氧化硫具有氧化性的实验现象为_________________________。
(2)为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为____________________________________________。
(3)当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用足量MnO2与浓盐酸反应制取氯气,其装置如图1所示: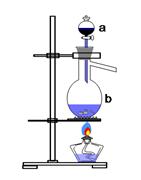

图1 图2
(1)图1中仪器a的名称是: ;仪器b的名称是: ;b中加入碎瓷片的作用是: 。
(2)请写出仪器b中发生的反应的离子方程式:
(3)检查装置的气密性之后的操作依次是: 、 、 。(填序号)
A.向烧瓶中加入MnO2粉末
B.加热
C.向烧瓶中加入浓盐酸
(4)该反应会因为盐酸浓度下降而停止。为了测定反应残留液中盐酸的浓度,某探究小组提出下列实验方案:
①甲同学的方案为:与足量AgNO3溶液反应,称量生成沉淀的质量。
②乙同学的方案为:与足量的锌反应,测量生成气体的体积,实验装置如图2所示(夹持装置已略去)。使Y形管中的残留溶液与锌粒反应的正确操作是 (“锌粒转移到残留溶液中”或“残留溶液转移到锌粒中”)。在正确读取量气管读数时,视线要平视,要注意使漏斗液面与量气管中液面相平,除此外还须注意: 。
两种方案我认为 (填甲或乙)同学的方案可行。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图是有关二氧化硫性质的实验装置图,实验时C装置中溴水溶液退色。试回答下列问题: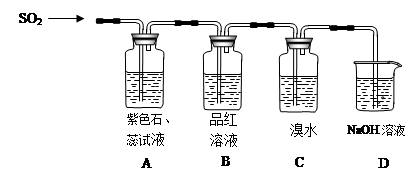
(1)A装置中的现象是 , B装置中的现象是 。
(2)二氧化硫具有:①漂白性 ②酸性氧化物性质 ③还原性 ④氧化性,在图中几个装置中对应表现出的性质是:A中 ;B中 ;C中 (填序号)。
(3)D中NaOH溶液的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com